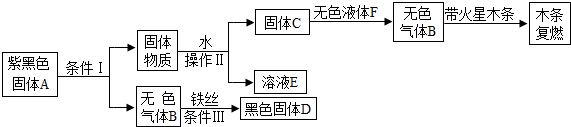
题目内容
某有机物3g在空气中充分燃烧,生成8.8g二氧化碳和5.4g水,分析该有机物的组成元素.
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和;
化学反应前后,元素的种类不变,原子的种类、总个数不变.
化学反应前后,元素的种类不变,原子的种类、总个数不变.
解答:解:方法一:8.8g二氧化碳中碳元素的质量为:8.8g×
×100%=2.4g,
5.4g水中氢元素的质量为:5.4g×
×100%=0.6g,
二氧化碳中的碳元素和水中的氢元素的质量和为:2.4g+0.6g=3g,
因为碳元素和氢元素来自于该有机物,所以该有机物中只含有碳元素和氢元素.
方法二:根据质量守恒定律可知,参加反应的氧气质量为:8.8g+5.4g-3g=11.2g,
8.8g二氧化碳中碳元素的质量为:8.8g×
×100%=2.4g,氧元素的质量为:8.8g-2.4g=6.4g,
5.4g水中氢元素的质量为:5.4g×
×100%=0.6g,氧元素的质量为:5.4g-0.6g=4.8g,
该有机物中碳元素的质量是2.4g,氢元素的质量是0.6g,氧元素的质量为:6.4g+4.8g-11.2g=0,
因此该有机物中只含有碳元素和氢元素.
| 12 |
| 44 |
5.4g水中氢元素的质量为:5.4g×
| 2 |
| 18 |
二氧化碳中的碳元素和水中的氢元素的质量和为:2.4g+0.6g=3g,
因为碳元素和氢元素来自于该有机物,所以该有机物中只含有碳元素和氢元素.
方法二:根据质量守恒定律可知,参加反应的氧气质量为:8.8g+5.4g-3g=11.2g,
8.8g二氧化碳中碳元素的质量为:8.8g×
| 12 |
| 44 |
5.4g水中氢元素的质量为:5.4g×
| 2 |
| 18 |
该有机物中碳元素的质量是2.4g,氢元素的质量是0.6g,氧元素的质量为:6.4g+4.8g-11.2g=0,
因此该有机物中只含有碳元素和氢元素.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.

练习册系列答案
相关题目
在下列实验现象的叙述中,正确的是( )
| A、硫在空气中燃烧发出明亮的蓝紫色火焰 |
| B、碳在氧气中燃烧产生白色的火焰,生成一种能使澄清石灰水变浑浊的气体 |
| C、铁丝在氧气中剧烈燃烧,火星四射,同时生成一种有刺激性气味的气体 |
| D、将硫酸铜的溶液和氢氧化钠溶液混合出现蓝色沉淀 |
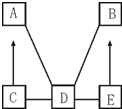 A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题:
A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类).已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐.图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去).回答下列问题: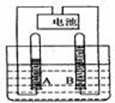 如图是电解水实验的示意图
如图是电解水实验的示意图