题目内容
200g某硫酸溶液恰好与13g锌完全反应,试计算:
(1)有多少克H2产生?
(2)该硫酸溶液溶质的质量分数?
(1)有多少克H2产生?
(2)该硫酸溶液溶质的质量分数?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:稀硫酸和锌反应生成硫酸锌和氢气,根据锌的质量可以计算生成氢气的质量和反应的硫酸质量,进一步可以计算该硫酸溶液溶质的质量分数.
解答:解:(1)设生成氢气的质量为x,反应的硫酸质量为y,
Zn+H2SO4═ZnSO4+H2↑,
65 98 2
13g y x
=
=
,
x=0.4g,y=19.6g,
答:生成氢气的质量为0.4g.
(2)该硫酸溶液溶质的质量分数为:
×100%=9.8%,
答:该硫酸溶液溶质的质量分数为9.8%.
Zn+H2SO4═ZnSO4+H2↑,
65 98 2
13g y x
| 65 |
| 13g |
| 98 |
| y |
| 2 |
| x |
x=0.4g,y=19.6g,
答:生成氢气的质量为0.4g.
(2)该硫酸溶液溶质的质量分数为:
| 19.6g |
| 200g |
答:该硫酸溶液溶质的质量分数为9.8%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
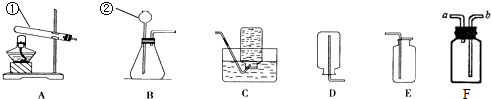
实验室里用高锰酸钾制取氧气的主要步骤有:①装入药品 ②检查装置的气密性 ③固定装置 ④加热 ⑤收集气体 ⑥熄灭酒精灯 ⑦将导管从水中取出.其中正确的操作顺序是( )
| A、①②③④⑤⑦⑥ |
| B、②①③④⑤⑦⑥ |
| C、①③②④⑤⑥⑦ |
| D、②①③④⑤⑥⑦ |
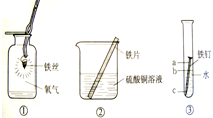 根据图 回答有关问题.
根据图 回答有关问题. ”表示
”表示