题目内容
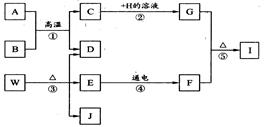
甲、乙、丙、丁是初中化学中常见的四种物质,它们有如下关系:①甲+乙→H2O,②乙+丁→CO2,③丙+乙→CO2+H2O.则甲是 ,乙中一定含 元素,丙物质是 (填一种最简单的有机化合物).
氢气,氧,甲烷.
①甲+乙→H2O,则甲和乙中含有氢元素和氧元素;②乙+丁→CO2,则乙和丁中含有碳元素和氧元素,故乙是氧气,一定含有氧元素,甲是氢气,丁中含有碳元素,③丙+乙→CO2+H2O,则可能是含碳氢元素的化合物燃烧的反应,最简单的有机物是甲烷,故丙是甲烷,故填:氢气,氧,甲烷.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
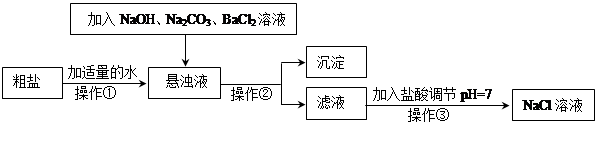 回答下列问题:
回答下列问题: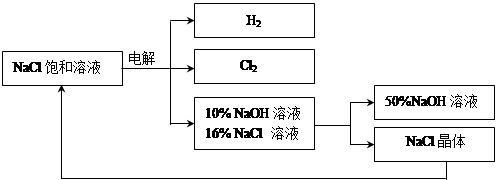
 Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)
Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH 。(填“升高”、“不变”、“降低”)