题目内容
【题目】请结合下列实验常用装置,回答有关问题。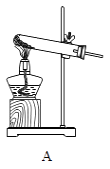
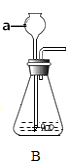
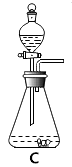
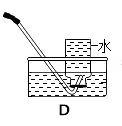
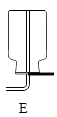
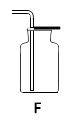
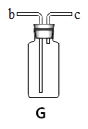
(1)写出图中标有字母的仪器名称:a、
(2)若用高锰酸钾制取氧气时,A装置中有一处明显的错误是 , 反应的化学方程式 , 若选用装置F收集时,确定氧气已经收集满的方法是。
(3)若用上述装置制取二氧化碳,则应选用的制取装置是 , 反应的化学方程式 , 用澄清石灰水检验二氧化碳,其反应的化学方程式为。
(4)若用C装置制取氢气时,该装置的优点是 , 若选用G装置进行收集该气体时,则气体从端进入(填“b”或“c”)
【答案】
(1)长颈漏斗
(2)试管口放一团棉花,2KMnO4 ![]() K2MnO4+MnO2+O2↑,将带火星的木条靠近集气瓶口,木条复燃则氧气已收集满
K2MnO4+MnO2+O2↑,将带火星的木条靠近集气瓶口,木条复燃则氧气已收集满
(3)B和F,CaCO3+2HCl=CaCl2+H2O+CO2↑,CO2+Ca(OH)2=CaCO3+H2O
(4)可以控制反应速率,c
【解析】(1)由图可知,a是长颈漏斗;(2)用高锰酸钾制取氧气时,试管口要放一团棉花,目的是防止高锰酸钾进入导管,使导管堵塞;加热高锰酸钾分解制取氧气的同时,还生成了锰酸钾和二氧化锰,故反应的化学方程式是2KMnO4 ![]() K2MnO4 +MnO2 + O2↑;装置F是向上排空气法收集氧气,验满的方法是将带火星的木条放在集气瓶口,木条复燃则氧气已收集满;(3)根据反应物的状态和反应条件选择发生装置,实验室用石灰石或大理石和稀盐酸反应制取二氧化碳,属于固液体常温下的反应,故选B作为发生装置;二氧化碳的密度比空气大,易溶于水,故只能用向上排空气法收集,选F装置;碳酸钙和稀盐酸反应生成二氧化碳的同时还生成了氯化钙和水:CaCO3+2HCl=CaCl2+H2O+CO2↑;澄清石灰水的主要成分是氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式表示为CO2 + Ca(OH)2 = CaCO3 ↓+ H2O;(4)实验室用锌和稀硫酸或稀盐酸反应制取氢气,金属锌接触到稀盐或稀硫酸后,反应便立即开始,不能人为控制其速率和生成氧气的量,故要控制其反应速率,可通过控制过氧化氢的加入量来实现;分液漏斗就可以控制加入液体药品的量和速率,故C装置的优点是可以控制反应速率;氢气的密度比空气小,会先聚集在集气瓶的上部,故氢气应从c端通入。
K2MnO4 +MnO2 + O2↑;装置F是向上排空气法收集氧气,验满的方法是将带火星的木条放在集气瓶口,木条复燃则氧气已收集满;(3)根据反应物的状态和反应条件选择发生装置,实验室用石灰石或大理石和稀盐酸反应制取二氧化碳,属于固液体常温下的反应,故选B作为发生装置;二氧化碳的密度比空气大,易溶于水,故只能用向上排空气法收集,选F装置;碳酸钙和稀盐酸反应生成二氧化碳的同时还生成了氯化钙和水:CaCO3+2HCl=CaCl2+H2O+CO2↑;澄清石灰水的主要成分是氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式表示为CO2 + Ca(OH)2 = CaCO3 ↓+ H2O;(4)实验室用锌和稀硫酸或稀盐酸反应制取氢气,金属锌接触到稀盐或稀硫酸后,反应便立即开始,不能人为控制其速率和生成氧气的量,故要控制其反应速率,可通过控制过氧化氢的加入量来实现;分液漏斗就可以控制加入液体药品的量和速率,故C装置的优点是可以控制反应速率;氢气的密度比空气小,会先聚集在集气瓶的上部,故氢气应从c端通入。
故答案为:(1)长颈漏斗;(2)试管口放一团棉花;2KMnO4![]() K2MnO4+MnO2+O2↑;将带火星的木条靠近集气瓶口,木条复燃则氧气已收集满
K2MnO4+MnO2+O2↑;将带火星的木条靠近集气瓶口,木条复燃则氧气已收集满
(3)B和F;CaCO3+2HCl=CaCl2+H2O+CO2↑;CO2+Ca(OH)2=CaCO3+H2O;(4)可以控制反应速率;c
(1)根据常用仪器的名称和题中所指仪器的作用解答
(2)高猛酸钾制氧气原理是高锰酸钾加热生成锰酸钾、二氧化锰和氧气,实验时在试管口要塞一团棉花,防止高猛酸钾粉末进入导管,将带火星的木条放在集气瓶口,若木条复燃说明氧气已满
(3)实验时制取二氧化碳的原料是石灰石或大理石与稀盐酸,因此反应装置选择固液不加热,原理是稀盐酸和碳酸钙生成氯化钙、水和二氧化碳,二氧化碳通到澄清石灰水中出现浑浊来检验,方程式为二氧化碳和氢氧化钙反应生成碳酸钙和水
(4)C装置中的分液漏斗可以控制加入液体的量,二氧化碳密度比空气大,用向上排空气法收集
