题目内容
【题目】小华同学在用稀盐酸和氢氧化钠溶液进行中和反应实验时,测得反应过程中溶液的酸碱度变化如下图所示。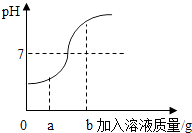
(1)该实验是将(选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入的溶液质量为a克时,向其所得溶液中加入碳酸钠溶液,可观察到的现象为
(3)当加入的溶液质量为b克时,所得溶液中溶质为(写化学式)。
(4)现有50g溶质质量分数为7.3%的稀盐酸溶液,则需要多少质量溶质质量分数为4%的氢氧化钠溶液才能恰好中和?
【答案】
(1)氢氧化钠溶液
(2)有气泡产生
(3)Na Cl、NaOH
(4)解:设当溶质质量分数为4%的氢氧化钠溶液的质量为x时,才能恰好中和。
NaOH + | HCl=NaCl+H2O |
40 | 36.5 |
x×4% | 50g×7.3% |
![]() =
= ![]() 解得x=100克
解得x=100克
【解析】(1)稀盐酸和氢氧化钠溶液反应的化学方程式为:NaOH+HCl═NaCl+H2O;开始时溶液的pH小于7,说明是把氢氧化钠溶液滴加到稀盐酸中;
(2)当加入溶液的质量为ag时,溶液的pH小于7,说明盐酸过量,向其所得溶液中加入碳酸钠溶液,可观察到的现象为有气泡产生;
(3)当加入溶液的质量为b克时,溶液的pH大于7,溶液显碱性,所得溶液中溶质为NaCl、NaOH;
(4)解:设当溶质质量分数为4%的氢氧化钠溶液的质量为x时,才能恰好中和。
NaOH + | HCl=NaCl+H2O |
40 | 36.5 |
x×4% | 50g×7.3% |
![]() =
= ![]() 解得x=100克
解得x=100克
答:需要100g溶质质量分数为4%的氢氧化钠溶液.
所以答案是:(1)氢氧化钠溶液;(2)有气泡产生;(3)NaCl、NaOH;(4)100克.
【考点精析】根据题目的已知条件,利用中和反应及其应用和根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握中和反应:酸与碱作用生成盐和水的反应;各物质间质量比=系数×相对分子质量之比.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).