题目内容
【题目】实验室的废液缸里有一定量的无色溶液,老师说废液中可能含硫酸钠、碳酸钠、氯化钠和氢氧化钠中的一种或几种。某化学活动小组的同学为确定溶液成分,进行如下探究。
(提出问题)废液缸的溶液中含有哪些离子呢?
(实验探究)小南和小岗两名同学进行如下实验:
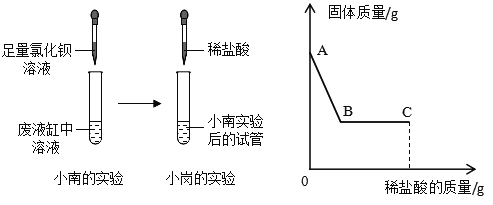
小南:取样于试管中,加入足量氯化钡溶液,发现有白色沉淀产生。
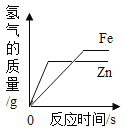
小岗:继续向小南实验后的试管中加入稀盐酸,试管中固体质量随加入稀盐酸质量 的变化情况如上右图。
(现象与结论)
小南的实验中产生白色沉淀反应的化学方程式可能是(1)_________;(写出一个即可)小岗实验中应该观察到的现象是(2)_________,小岗实验后的试管中一定含有的阳离子为(3)_____(填离子符号,下同);
由上述实验可知:废液缸溶液中一定不含的离子是(4)_____,理由是(5)_____。
(表达与交流)
为了确定废液缸中可能存在的离子是否存在,同学们经过讨论后一致认为:重新取样,向样品中加入足量的硝酸钡溶液,这样做的目的是排除(6)_____对(7)_____的验证产生的干扰,然后再加入(8)_____溶液,若出现明显实验现象,从而确定可能存在的离子一定存在。
【答案】Na2CO3+BaCl2=2NaCl+BaCO3↓或Na2SO4+BaCl2=BaSO4↓+2NaCl 有气泡产生 Na+、Ba2+ OH- 如果有氢氧化钠,稀盐酸会先于氢氧化钠反应,滴加稀盐酸固体质量不会一开始就减少 SO42-和CO32 Cl- 硝酸银
【解析】
取样于试管中,加入足量氯化钡溶液,发现有白色沉淀产生,继续向试管中加入稀盐酸,试管中沉淀质量减小,但是没有减小到0,说明沉淀是硫酸钡和碳酸钡沉淀的混合物,证明废液缸里有碳酸钠和硫酸钠。
[现象与结论]
取样于试管中,加入足量氯化钡溶液,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的方程式为:Na2CO3+BaCl2=2NaCl+BaCO3↓,Na2SO4+BaCl2=BaSO4↓+2NaCl;碳酸钡和稀盐酸反应生成二氧化碳气体,小岗实验中应该观察到的现象是有气泡产生;小岗实验后的试管中一定含有氯化钠和过量的氯化钡,一定有的阳离子为钠离子和钡离子。
故填:Na2CO3+BaCl2=2NaCl+BaCO3↓或Na2SO4+BaCl2=BaSO4↓+2NaCl;有气泡产生;Na+、Ba2+;
由上述实验可知:滴加稀盐酸就马上有固体减少,说明废液中不含氢氧化钠,如果有氢氧化钠,稀盐酸会先于氢氧化钠反应,滴加稀盐酸固体质量不会一开始就减少。
故填:OH-;如果有氢氧化钠,稀盐酸会先于氢氧化钠反应,滴加稀盐酸固体质量不会一开始就减少;
[表达与交流]
通过上述实验证明了废液中含有硫酸钠、碳酸钠,不含氢氧化钠,可能含有氯化钠,为了确定废液缸中可能存在氯化钠,重新取样,向样品中加入足量的硝酸钡溶液,这样做的目的是排除SO42-和CO32-对Cl-的验证产生的干扰,然后再加入硝酸银溶液,若出现白色沉淀象,从而确定氯离子一定存在。
故填:SO42-和CO32-;Cl-;硝酸银。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案