题目内容
【题目】(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
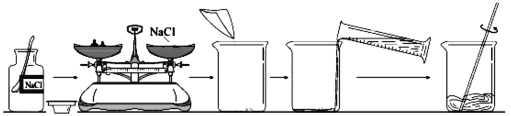
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
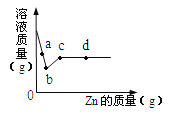
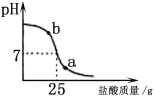
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答:
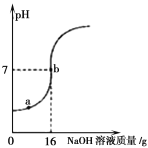
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
【答案】(1)①药品瓶盖正放在了桌面上 ②砝码和药品位置颠倒
(2)①计算有错误②天平读数有误③氯化钠中有杂质④烧杯中原先有水⑤水量多了⑥天平未调零
(3)溶液稀释前后,溶质的质量不变 195 g 量取
(4)①Na+、H+、SO42- ②0.8 ③9.8%
【解析】
试题分析:(1)图中的两处错误①药品瓶盖正放在了桌面上,②砝码和药品位置颠倒
(2)若所配制的盐水中NaCl 的质量分数小于6%,根据质量分数计算的表达式,可分析要不是溶质NaCl的质量偏小,要不是溶剂水的质量偏大,所以可能造成误差的原因有:①计算有错误②天平读数有误③氯化钠中有杂质④烧杯中原先有水⑤水量多了⑥天平未调零等
(3)溶液的加水稀释过程中,计算的依据是溶液稀释前后,溶质的质量不变,质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,可设需水的质量为x,可列式:50g×98%=(50g+x)×20%,x=195g,配制溶液的步骤是:计算、量取、混匀、冷却至室温装瓶并贴上标签
(4)①从溶液pH的变化图看出,a点溶液pH<7,显酸性,所以溶液中含有的物质有除了反应生成的Na2SO4 ,还有过量的硫酸,所以离子有:Na+、H+、SO42-
②当pH=7时,消耗NaOH溶液质量为16g,含NaOH的质量=16g×5%=0.8g
③根据化学反应方程式:2NaOH+H2SO4==Na2SO4+2H2O中NaOH与H2SO4的质量关系,可求出H2SO4的质量,进一步计算稀硫酸的溶质质量分数
解:设10g稀硫酸中含H2SO4的质量为x
H2SO4 + 2NaOH ===Na2SO4 + 2 H2O
98 80
x 0.8g
![]()
x = 0.98g
稀硫酸的溶质质量分数为![]()
答:稀硫酸的溶质质量分数为9.8%

 期末集结号系列答案
期末集结号系列答案