题目内容
【题目】t1℃时,将甲、乙两种固体(均不含结晶水)各18g,分别加入盛有100g水的烧杯中,充分搅拌后现象如图1所示,升温到t2℃时,现象如图2所示,甲、乙两种固体在水中的溶解度曲线如图3所示。
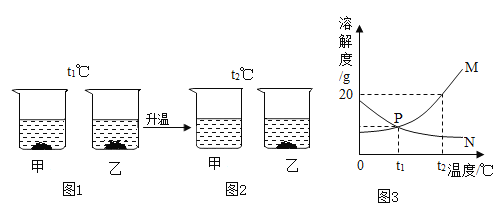
请回答问题:
(1)P点表示的意义是_____。
(2)从t1℃到t2℃的变化过程中,一直处于饱和状态的是_____(填“甲”或“乙”)的溶液。
(3)图3中曲线M表示的是_____(填“甲”或“乙”)的溶解度曲线。
(4)若甲中混有少量的乙,可采用_____结晶的方法提纯甲。
【答案】t1℃时,甲、乙两种物质溶解度相等 乙 甲 降温
【解析】
对比图1和图2,温度升高甲固体消失,说明甲的溶解度随温度的升高而增大,温度升高乙固体增多,说明乙的溶解度随温度的升高而减小。分析图3甲、乙溶解度曲线可知,M为甲,溶解度曲线随温度的升高而增大,N为乙,溶解度曲线随温度的升高而减小。
(1)P点为甲、乙两物质溶解度曲线的交点,表示的意义是t1℃时,甲、乙两种物质溶解度相等。
(2)甲的溶解度曲线随温度的升高而增大,乙的溶解度是随温度升而减小,从图1可以知,在t1℃时甲、乙溶液达到饱和,温度从t1℃到t2℃的变化过程中,甲溶解度增大,甲固体不断溶解直至消失,可能处于不饱和状态,乙溶解度减小,析出固体。所以,一直处于饱和状态的是乙的溶液。
(3)对比图1和图2,温度升高甲固体消失,说明甲的溶解度随温度的升高而增大,所以图3中曲线M表示的是甲的溶解度曲线。
(4)因为甲的溶解度曲线随温度的升高而增大,乙的溶解度是随温度升而减小,所以若甲中混有少量的乙,可采用降温结晶的方法提纯甲。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】将乙醇和氧气置于密闭容器中引燃,测得反应前后各物质的质量如下:
物质(纯净物) | 乙醇 | 氧气 | 二氧化碳 | 水 | M |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | X | Y |
表格中“X、Y”分别为_____;若要使生成物中无物质M,需要再增加氧气的质量为_____g。
【题目】为探究化学反应前后物质的质量关系,设计如下实验方案:
实验原理:铁与硫酸铜溶液反应。
实验用品:①带胶塞的维形瓶;②托盘天平。
实验药品:①打磨好的铁钉;②装于试剂瓶内足量的硫酸钢溶液。
步骤Ⅰ:称量并记录相关物质的质量m1
步骤Ⅱ:将缺钉浸到硫酸铜溶液中,待有现象后,称量并记录相关物质的质量m2
(1)写出铁钉与硫酸铜溶液反应的化学方程式。______________
(2)步骤Ⅰ中,如何比较合理地称量到相关物质的质量m1?_______________________
(3)实验结束后,处理记录的相关数据。请你完成空白处的填写
仪器和用品 | 物质 | |
步骤Ⅰ中相关物质质量m1 | 带胶塞的锥形瓶 | 水、_______ |
步骤Ⅱ中相关物质质量m2 | 带胶塞的锥形瓶 | 水、_______ |
实验结论 | _______ | |