题目内容
某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
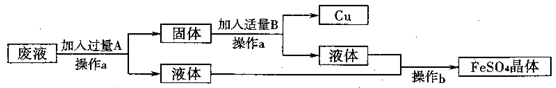
(1)操作a、b的名称分别是_______、_______。
(2)写出流程中有关反应的化学方程式__________、______________。
(3)以上两个反应能够发生的原因是________。

(1)操作a、b的名称分别是_______、_______。
(2)写出流程中有关反应的化学方程式__________、______________。
(3)以上两个反应能够发生的原因是________。
(1)过滤 蒸发
(2)Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑
(3)在金属活动性顺序中,铁位于铜、氢之前
(2)Fe+CuSO4=FeSO4+Cu Fe+H2SO4=FeSO4+H2↑
(3)在金属活动性顺序中,铁位于铜、氢之前
(1)经过操作a能得到固体和液体,故a操作为过滤,从液体中得到晶体可以是蒸发操作,所以本题答案为:过滤,蒸发;
(2)经过操作a得到的液体中能得到硫酸亚铁,说明回收铜时加入的是铁,多余的铁与硫酸反应生成硫酸亚铁,故答案为:Fe+CuSO4=FeSO4+Cu,Fe+H2SO4=FeSO4+H2↑
(3)根据金属活动性,铁在氢前可以跟酸反应,铁在铜的前面,故可以将硫酸铜中的铜置换出来。
(2)经过操作a得到的液体中能得到硫酸亚铁,说明回收铜时加入的是铁,多余的铁与硫酸反应生成硫酸亚铁,故答案为:Fe+CuSO4=FeSO4+Cu,Fe+H2SO4=FeSO4+H2↑
(3)根据金属活动性,铁在氢前可以跟酸反应,铁在铜的前面,故可以将硫酸铜中的铜置换出来。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案
相关题目