题目内容
今天是学校化学实验室的开放日,小明和小亮怀着愉悦的心情来到实验室,他们要配制10%的氢氧化钠溶液作叶脉书签,却发现盛有装氢氧化钠固体的试剂瓶的瓶盖松动了.
【提出质疑】氢氧化钠是否变质?
【回忆与实践】
(1)氢氧化钠固体需要密封保存;氢氧化钠固体露置于空气中容易变质的原因可用化学方程式表示为
(2)要检验该瓶氢氧化钠是否变质,可选择的试剂 是
(3)经过检验,发现该氢氧化钠固体只是部分变质,同学们共设计出以下3种方案来除去其中杂质.
方案①:溶液,加入适量的稀盐酸,至没有气泡产生时,蒸发结晶.
方案②:溶解,加入适量的氢氧化钙溶液,至不再产生沉淀时,过滤,蒸发结晶.
方案③:溶液,加入适量的氯化钡溶液,至不再产生沉淀时,过滤,蒸发结晶.
经讨论,大家一致认为只有方案②可行.请你说明③不可行的主要原因.
【配制溶液】利用方案②得到的固体氢氧化钠配制溶液:
a 计算配制50g质量分数为10%的氢氧化钠溶液:需要氢氧化钠固体5g,水45g.
b 调节天平平衡后,在两个托盘上各放一张干净的大小相同的纸片,把称量物放在左盘纸上,砝码放在右盘纸上,称量所需的氢氧化钠,倒入烧杯中.
c 把水的密度近似看作1g/cm3.用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,用温度计搅拌,使氢氧化钠溶解,温度计温度升高.
d 把配好的溶液倒入试剂瓶中,盖好橡皮胶塞,并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中,以备下次使用.
上述的叙述中,有两处错误请将它们改正过来:
【反思与拓展】做好叶脉书签后,少明反思到:氢氧化钠中混有碳酸钠我已经会除去了;那么如果是碳酸钠溶液中混有少量氢氧化钠可以
【提出质疑】氢氧化钠是否变质?
【回忆与实践】
(1)氢氧化钠固体需要密封保存;氢氧化钠固体露置于空气中容易变质的原因可用化学方程式表示为
2NaOH+CO2=Na2CO3+H2O
2NaOH+CO2=Na2CO3+H2O
.(2)要检验该瓶氢氧化钠是否变质,可选择的试剂 是
稀盐酸
稀盐酸
.(3)经过检验,发现该氢氧化钠固体只是部分变质,同学们共设计出以下3种方案来除去其中杂质.
方案①:溶液,加入适量的稀盐酸,至没有气泡产生时,蒸发结晶.
方案②:溶解,加入适量的氢氧化钙溶液,至不再产生沉淀时,过滤,蒸发结晶.
方案③:溶液,加入适量的氯化钡溶液,至不再产生沉淀时,过滤,蒸发结晶.
经讨论,大家一致认为只有方案②可行.请你说明③不可行的主要原因.
引进新杂质
引进新杂质
.【配制溶液】利用方案②得到的固体氢氧化钠配制溶液:
a 计算配制50g质量分数为10%的氢氧化钠溶液:需要氢氧化钠固体5g,水45g.
b 调节天平平衡后,在两个托盘上各放一张干净的大小相同的纸片,把称量物放在左盘纸上,砝码放在右盘纸上,称量所需的氢氧化钠,倒入烧杯中.
c 把水的密度近似看作1g/cm3.用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,用温度计搅拌,使氢氧化钠溶解,温度计温度升高.
d 把配好的溶液倒入试剂瓶中,盖好橡皮胶塞,并贴上标签(标签中应包括药品的名称和溶液中溶质的质量分数),放到试剂柜中,以备下次使用.
上述的叙述中,有两处错误请将它们改正过来:
称量物放在玻璃器皿中(如烧杯表面皿)
称量物放在玻璃器皿中(如烧杯表面皿)
、用玻璃棒搅拌
用玻璃棒搅拌
;请将标签填好.氢氧化钠(溶液) 氢氧化钠(溶液) |
10% 10% |
二氧化碳(CO2)
二氧化碳(CO2)
除去氢氧化钠;如果氯化钾溶液中混有少量硫酸钾可以加入氯化钡(BaC12)
氯化钡(BaC12)
除去硫酸钾.分析:【回忆与实践】
(1)根据氢氧化钠溶液和空气中的二氧化碳反应生成碳酸钠和水进行解答;
(2)根据碳酸钠和稀盐酸反应生成二氧化碳气体进行解答;
(3)根据氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钠属于新的杂质进行解答;
【配制溶液】根据氢氧化钠具有腐蚀性以及溶解时用玻璃棒搅拌进行解答;
【反思与拓展】根据二氧化碳和氢氧化钠溶液反应生成碳酸钠和水以及氯化钡和硫酸钾溶液反应生成氯化钾和硫酸钡沉淀进行解答.
(1)根据氢氧化钠溶液和空气中的二氧化碳反应生成碳酸钠和水进行解答;
(2)根据碳酸钠和稀盐酸反应生成二氧化碳气体进行解答;
(3)根据氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钠属于新的杂质进行解答;
【配制溶液】根据氢氧化钠具有腐蚀性以及溶解时用玻璃棒搅拌进行解答;
【反思与拓展】根据二氧化碳和氢氧化钠溶液反应生成碳酸钠和水以及氯化钡和硫酸钾溶液反应生成氯化钾和硫酸钡沉淀进行解答.
解答:解:【回忆与实践】
(1)氢氧化钠溶液和空气中的二氧化碳反应生成碳酸钠和水,化学方程式表示为2NaOH+CO2=Na2CO3+H2O;
(2)碳酸钠和稀盐酸反应生成二氧化碳气体,所以要检验该瓶氢氧化钠是否变质,可选择的试剂是稀盐酸;
(3)氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钠属于新的杂质,所以③不可行;
【配制溶液】氢氧化钠具有腐蚀性,所以称量氢氧化钠需要放在玻璃器皿中(如烧杯表面皿);溶解时用玻璃棒搅拌,而不用温度计;
【反思与拓展】二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,所以碳酸钠溶液中混有少量氢氧化钠可以二氧化碳除去氢氧化钠;氯化钡和硫酸钾溶液反应生成氯化钾和硫酸钡沉淀,所以氯化钾溶液中混有少量硫酸钾可以加入氯化钡除去硫酸钾.
故答案为:
【回忆与实践】
(1)2NaOH+CO2=Na2CO3+H2O;
(2)稀盐酸;
(3)引进新杂质;
【配制溶液】称量物放在玻璃器皿中(如烧杯表面皿);用玻璃棒搅拌;
【反思与拓展】二氧化碳(CO2);氯化钡(BaC12).
(1)氢氧化钠溶液和空气中的二氧化碳反应生成碳酸钠和水,化学方程式表示为2NaOH+CO2=Na2CO3+H2O;
(2)碳酸钠和稀盐酸反应生成二氧化碳气体,所以要检验该瓶氢氧化钠是否变质,可选择的试剂是稀盐酸;
(3)氯化钡溶液和碳酸钠反应生成碳酸钡沉淀和氯化钠,氯化钠属于新的杂质,所以③不可行;
【配制溶液】氢氧化钠具有腐蚀性,所以称量氢氧化钠需要放在玻璃器皿中(如烧杯表面皿);溶解时用玻璃棒搅拌,而不用温度计;
【反思与拓展】二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,所以碳酸钠溶液中混有少量氢氧化钠可以二氧化碳除去氢氧化钠;氯化钡和硫酸钾溶液反应生成氯化钾和硫酸钡沉淀,所以氯化钾溶液中混有少量硫酸钾可以加入氯化钡除去硫酸钾.
故答案为:
【回忆与实践】
(1)2NaOH+CO2=Na2CO3+H2O;
(2)稀盐酸;
(3)引进新杂质;
【配制溶液】称量物放在玻璃器皿中(如烧杯表面皿);用玻璃棒搅拌;
| 氢氧化钠(溶液) |
| 10% |
点评:本题中要知道氢氧化钠变质的原因,要熟练掌握实验室中检验碳酸盐的方法,检验氢氧化钠与碳酸钠的混合物时,可先把碳酸钠变成沉淀并且不生成影响氢氧化钠检验的碱性物质,然后使用酚酞检验氢氧化钠.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
今天是学校化学实验室开放日,张老师拿出两瓶无标签的试剂,通过观察已知它们分别是固体和液体.张老师分别取少量试剂在试管中混合,立即产生了一种无色气体.同学们对此气体展开了一系列研究:
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
产生此气体的化学方程式可能是 .
②晓聪想在实验室制取该气体,他采用的发生装置可选取下图中的 (填序号);收集装置是 (填序号).
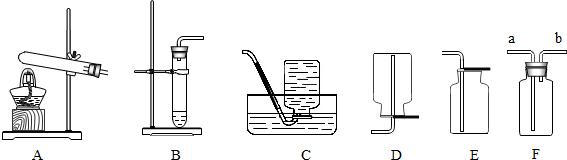
③如用图中F装置收集该气体,气体由 端(填“a”或“b”)导入.
(2)晓明猜想此无色气体还可能是另外一种气体,实验室制备它的化学方程式是: .
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是 |
②晓聪想在实验室制取该气体,他采用的发生装置可选取下图中的

③如用图中F装置收集该气体,气体由
(2)晓明猜想此无色气体还可能是另外一种气体,实验室制备它的化学方程式是:
今天是学校化学实验室开放日,张老师拿出两瓶无标签的试剂,通过观察已知它们分别是固体和液体.张老师分别取少量试剂在试管中混合,立即产生了一种无色气体.同学们对此气体展开了一系列研究:
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
产生此气体的化学方程式可能是______ 2H2O+O2↑
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是______ |
今天是学校化学实验室开放日,张老师拿出两瓶无标签的试剂,通过观察已知它们分别是固体和液体.张老师分别取少量试剂在试管中混合,立即产生了一种无色气体.同学们对此气体展开了一系列研究:
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
产生此气体的化学方程式可能是______ 2H2O+O2↑
(1)①此气体是什么物质?晓聪提出了他的猜想,并设计了关于验证它的实验方案如下表,请你帮助填写(只写一种猜想):
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是______ |

