题目内容
【题目】某化学兴趣小组学习酸、碱、盐性质后,通过实验对硫酸、氢氧化钙的化学性质进行了验证和总结,如图所示“![]() ”表示物质两两之间能发生化学反应.请根据图,回答问题.
”表示物质两两之间能发生化学反应.请根据图,回答问题.
总结一:硫酸的化学性质

①写出氧化铁与硫酸的化学方程式 .
②补充一个实验,完善硫酸的化学性质,X可以是 (用化学式表示).
③能发生中和反应的化学方程式 .
④为测定某硫酸中溶质的质量分数,甲同学取该硫酸样品50g,向其中加入过量锌粒,充分反应后收集到0.2克氢气,请完成下列计算与分析:
Ⅰ.收集到的氢气是: mol
Ⅱ.计算:该硫酸中溶质的质量分数. (根据化学方程式计算于上方空白处)
总结二:氢氧化钙的化学性质

(已知:CaCl2溶液呈中性,CaCl2+Na2CO3→CaCO3↓+2NaCl)
⑤乙同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈
(填“酸性”、“碱性”或“中性”).
⑥丙同学将过量的稀盐酸加入到乙同学所得溶液中,观察到红色褪去,此时所得溶液中含有的溶质有 (酸碱指示剂除外).请设计实验证明盐酸过量: ,
⑦丁同学将碳酸钠溶液加入滴有酚酞的氢氧化钙溶液中,充分反应后,观察到的
现象: ; 反应后溶液中的溶质有 .
【答案】(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)Na2CO3(能与硫酸反应的盐);
(3)H2SO4+2NaOH═Na2SO4+2H2O;
(4)Ⅰ、0.1mol;
Ⅱ、19.6%;
(5)碱性;
(6)氯化钙和氯化氢;向溶液中滴加石蕊试液,若变红,则证明盐酸过量;
(7)产生白色沉淀;氢氧化钠.
【解析】
试题分析:(1)根据氧化铁与硫酸的化学反应正确书写化学方程式;
(2)根据酸的化学性解答;
(3)根据要求正确书写化学方程式;
(4)Ⅰ.根据氢气的质量来计算氢气的物质的量;
Ⅱ.根据化学方程式计算;
(5)根据能使酚酞变红色的溶液显碱性解答;
(6)根据氢氧化钙与盐酸反应的化学方程式,以及反应物是否有剩余等解答;
(7)根据实验现象来确定溶液成分.
解:(1)氧化铁与硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)根据酸的化学性质X为能与硫酸反应的盐;
(3)图中能发生中和反应的是氢氧化钠与稀硫酸,反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O;
(4)Ⅰ解:氢气的物质的量:0.2g÷2g/mol=0.1mol;
Ⅱ、解:设硫酸中溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
98 2
x 0.2g
![]() x=9.8g
x=9.8g
酸中溶质的质量分数:![]() =19.6%;
=19.6%;
(5)能使酚酞变红色的溶液显碱性;
(6)氢氧化钙与盐酸反应生成了氯化钙和水,所加盐酸过量,故所得溶液中含有的溶质有氯化钙和氯化氢;可向溶液中滴加石蕊试液,若变红,则证明盐酸过量;
(7)丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,生成了氢氧化钠和碳酸钙沉淀,故可看到产生白色沉淀,反应后溶液中的溶质有氢氧化钠.
答案:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)Na2CO3(能与硫酸反应的盐);
(3)H2SO4+2NaOH═Na2SO4+2H2O;
(4)Ⅰ、0.1mol;
Ⅱ、19.6%;
(5)碱性;
(6)氯化钙和氯化氢;向溶液中滴加石蕊试液,若变红,则证明盐酸过量;
(7)产生白色沉淀;氢氧化钠.

【题目】如图所示,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能使气球a明显鼓起的是( )
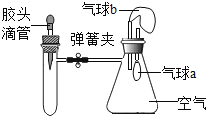
试管内物质 | 胶头滴管内物质 | |
A | 氢氧化钠固体 | 水 |
B | 氧化铁 | 稀盐酸 |
C | 氯化钡溶液 | 稀硫酸 |
D | 二氧化碳 | 氢氧化钠溶液 |
A.A B.B C.C D.D
【题目】现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案:
【实验一】取三份碱性调味液各100g,分别缓慢加入到20g、40g和60g某盐酸中,测得三组实验数据见下表(气体的溶解忽略不计):
第1组 | 第2组 | 第3组 | |
盐酸的质量/g | 20 | 40 | 60 |
生成气体的质量/s | 2.2 | 4.4 | 5.5 |
根据实验及有关数据进行分析与计算:
(1)上述三组实验中,碳酸钠有剩余的是哪几组? ;
(2)100g碱性调味液中碳酸钠的质量为 g;
(3)100g碱性调味液与该盐酸恰好反应时,需盐酸的质量为 g,
(4)【实验二】在上述第3组反应后的溶液中滴加AgNO3溶液,绘得生成沉淀的质量随滴加AgNO3溶液质量的曲线如图.根据实验及有关数据计算碱性调味液中氯化钠的质量分数.