题目内容
【题目】食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富。
(1)海水晒盐的原理是 。
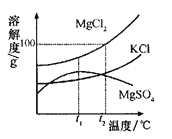
(2)晒盐过程中得到粗盐和卤水。卤水的主要成分及其溶解度的变化如右图。t2℃时,MgCl2的溶解度为 g。将t2℃时MgCl2、KCl和MgS04三种物质的饱和溶液分别降温至t1℃时,析出晶体的是 (填化学式)。
(3)将纯净的氯化钠固体配制成溶液。20℃时,向4个盛有50g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4组实验数据如下表:
实验序号 | ① | ② | ③ | ④ |
加入氯化钠的质量/g | 4.5 | 9 | 18 | 20 |
溶液质量/g | 54.5 | 59 | 68 | 68 |
关于上述实验的叙述不正确的是 (填字母序号)。
A.①②所得溶液是该温度下的不饱和溶液
B.③④所得溶液溶质的质量分数相等
C.20℃时,氯化钠的溶解度为36g
D.20℃时,将④恒温蒸发25g水,过滤得18g固体
【答案】(1)利用阳光风力蒸发水分得到食盐(蒸发结晶)
(2) 100g MgCl2、KCl(3)D
【解析】
试题分析:(1)结晶(提取溶质)的方法一般有蒸发溶剂,冷却热饱和溶液,晒盐是利用阳光风力蒸发水分得到食盐;(2)由曲线图可知;由图t2℃降温至t1℃时MgCl2、KCl的溶解度降低而MgS04的溶解度却是增高的,故只有MgCl2和KCl会析出;(3)由表可知,在加入18g氯化钠时,溶液质量不再增加即此时达到饱和,A.①②所得溶液仍可以继续溶解氯化钠,为不饱和溶液,正确;B、③饱和继续加溶质也不再溶解,溶液不会改变,因此③④所得溶液为相同的溶液,溶质的质量分数相等,正确;C、20℃时,50g水溶解18g氯化钠达到饱和,100g水就溶解36g达到饱和,溶解度为一定温度下,某物质溶解在100g溶剂中达到饱和所需的质量,因此正确;D、20℃时,25g水最多溶解9g氯化钠,④中加入的氯化钠为20g,恒温蒸发25g水,那么不能溶解的溶质为20g—9g=11g,过滤得到11g固体,不正确。