题目内容
 实验室里有一瓶标签残缺的盐酸,请你来探究:
实验室里有一瓶标签残缺的盐酸,请你来探究:(1)怎样立即确定它是不是浓盐酸?有人猜测是,有人记得好像不是.你认为应该用下述中的
C
C
(填选项编号)方法立即确认.A.讨论B.调查 C.实验 D.上网
具体的做法是
打开瓶塞,若瓶口有白雾冒出的是浓盐酸,否则不是浓盐酸
打开瓶塞,若瓶口有白雾冒出的是浓盐酸,否则不是浓盐酸
.(2)粗略测定每毫升该盐酸中所含溶质HCl的质量.同学们依据酸碱中和反应的原理,设计了一种可行的方案,其操作步骤如下:
(1)在小烧杯中加入10g5%的NaOH溶液;
(2)向上述烧杯中滴入2滴酚酞试液;
(3)向10mL的量筒里注入该盐酸至一定刻度;
(4)用胶头滴管吸取量筒内的盐酸,逐滴滴入上述烧杯中,直到溶液刚好变成无色时为止;
(5)记录实验数据;
(6)计算,确定每毫升盐酸中含溶质HCl的质量.
请你根据以上实验过程,回答下列问题,
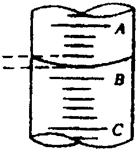
①第3步向量筒中注入盐酸,量筒中液面的位置如图所示,a与b、b与c的刻度均相差1mL,如果刻度a为7,量筒中盐酸的体积为
6.2
6.2
mL.②第4步要用到玻璃棒,它是起
搅拌
搅拌
作用,目的是反应物混合均匀,充分反应
反应物混合均匀,充分反应
;停止滴入盐酸后,胶头滴管中残留的盐酸应全部滴入量筒中
全部滴入量筒中
.③第4步操作中指示剂(酚酞试液)颜色突变所表示的含义是什么?
④第5步要记录的实验数据是
量筒中剩余盐酸的体积(或中和NaOH用去的盐酸体积)
量筒中剩余盐酸的体积(或中和NaOH用去的盐酸体积)
.分析:(1)根据常见的处理问题的方法来解决,其中进行实验是我们首选的方法,也是最可信的方法.
(2)①读数时,量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平,再读出液体体积,所以可以知道图中所示的盐酸的体积为6.2mL.
②根据反应物质接触越充分,反应越完全可以知道玻璃棒的作用为搅拌以使反应更充分;其中为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以剩余的盐酸应该放回量筒.
③根据酚酞遇酸碱性物质显示不同的颜色来进行解答;
④为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,可以据此解答.
(2)①读数时,量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平,再读出液体体积,所以可以知道图中所示的盐酸的体积为6.2mL.
②根据反应物质接触越充分,反应越完全可以知道玻璃棒的作用为搅拌以使反应更充分;其中为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以剩余的盐酸应该放回量筒.
③根据酚酞遇酸碱性物质显示不同的颜色来进行解答;
④为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,可以据此解答.
解答:解:(1)根据题给的四个选项可以知道,用实验的方法可以判断是否为浓盐酸,由于浓盐酸具有挥发性,所以可以打开瓶塞观察是否产生了白雾即可;
(2))①读数时,量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平,再读出液体体积.
②根据反应物质接触越充分,反应越完全来解答,其中为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以剩余的盐酸应该放回量筒;
③酚酞遇碱变红,但是在中性溶液和酸性溶液中不变色,所以颜色突变说明氢氧化钠和稀盐酸恰好完全反应了.
④为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以应该记录量筒中剩余的盐酸的体积,或是与氢氧化钠恰好完全反应所消耗的盐酸的体积.
故答案为:(1)C;打开瓶塞,若瓶口有白雾冒出的是浓盐酸,否则不是浓盐酸.
(2)①6.2;
②搅拌;使反应物混合均匀,充分反应;全部滴入量筒中;
③指示NaOH与HCl此时恰好反应(中和);
④量筒中剩余盐酸的体积(或中和NaOH用去的盐酸体积).
(2))①读数时,量筒必须放平,视线要跟量筒内液体的凹液面的最低处保持水平,再读出液体体积.
②根据反应物质接触越充分,反应越完全来解答,其中为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以剩余的盐酸应该放回量筒;
③酚酞遇碱变红,但是在中性溶液和酸性溶液中不变色,所以颜色突变说明氢氧化钠和稀盐酸恰好完全反应了.
④为了测量盐酸的质量分数,必须知道恰好完全反应时消耗掉盐酸的体积,所以应该记录量筒中剩余的盐酸的体积,或是与氢氧化钠恰好完全反应所消耗的盐酸的体积.
故答案为:(1)C;打开瓶塞,若瓶口有白雾冒出的是浓盐酸,否则不是浓盐酸.
(2)①6.2;
②搅拌;使反应物混合均匀,充分反应;全部滴入量筒中;
③指示NaOH与HCl此时恰好反应(中和);
④量筒中剩余盐酸的体积(或中和NaOH用去的盐酸体积).
点评:此题是一道实验设计题,解题的关键是对实验原理以及相关计算的掌握,解决此题对训练学生相关的严密思维有一定好处.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目