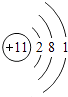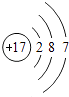题目内容
【题目】课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40 g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
实验一 | 实验二 | 实验三 | 实验四 | |
原固体混合物质量 | 10g | 10g | 10g | 10g |
加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
生成的沉淀的质量 | 2g | m | 5g | 5g |
请分析表中数据回答并计算[(4)要求写计算过程]
(1)生成的沉淀是(填写化学式)
(2)10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为g.
(3)m=g.
(4)原固体混合物中Na2CO3的质量分数是多少?
【答案】
(1)CaCO3
(2)5
(3)4
(4)解:设10g原固体混合物中Na2CO3质量为x
CaCl2+ | Na2CO3= | CaCO3↓+2NaCl |
106 | 100 | |
x | 5g |
![]() =
= ![]()
解之得x=5.3g
![]() ×100%=53%
×100%=53%
答:原固体混合物中Na2CO3的质量分数是53%
【解析】解:(1)据题意可知此反应的方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl,故沉淀物是CaCO3(2)据图表可知,加入CaCl2溶液的质量到30g和40g时的沉淀质量一样多,说明加到30g 时已完全反应,故最多生成沉淀质量为5g(3)在反应过程中,参加反应的物质与生成物的质量成正比,因此 ![]() ,故m=4g
,故m=4g
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

【题目】下面是元素周期表中某些元素的部分信息,请回答下列问题:
第3周期 | 11 Na | 镁 | … | 16 S | 17 Cl | 18 Ar |
第4周期 | 19 K | 20 Ca | … | |||
(1)Mg元素的核电荷数= .
(2)钠元素和硫元素处于同一周期的原因是 .
(3)钠元素和钾元素的化学性质相似的原因是 .
(4)请写出钾元素和硫元素形成的化合物的化学式 .