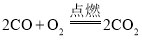题目内容
【题目】在实验室里用浓度为98%的浓硫酸和蒸馏水配制稀硫酸。
(1)要配制19.6%的稀硫酸100g,需要98%的浓硫酸_____g;
(2)量取和混匀操作中需要的玻璃仪器包括烧杯、量筒、胶头滴管和_____;
(3)如果量取水时仰视读数,其它操作正确,则配制出的稀硫酸的浓度会比19.6%_____;
(4)用上述稀硫酸与足量锌粒完全反应能生成氢气_____g。
【答案】20 玻璃棒 小 0.4
【解析】
(1)设需要98%的浓硫酸的质量为x。稀释前后,溶质的质量不变,则100g×19.6%=x×98%,解得x=20g。故答案为:20;
(2)量筒与胶头滴管用于准确量取浓硫酸和水,烧杯用于完成混合均匀的操作,玻璃棒用于混合时的搅拌。故答案为:玻璃棒;
(3)用量筒量取水时,仰视液面,读数会比实际液体体积小,会造成实际量取的水的体积偏大,则配出的稀硫酸的浓度会偏小。故答案为:小;
(4)100g,19.6%的稀硫酸中,硫酸的质量为:100g×19.6%=19.6g。锌和硫酸反应生成硫酸锌和氢气。在化学反应中,反应前后元素的质量不变,且足量的锌和稀硫酸反应,则硫酸完全消耗,反应后生成氢气的质量为硫酸中氢元素的质量。则硫酸中,氢元素的质量为:19.6g×![]() =0.4g。故答案为:0.4g。
=0.4g。故答案为:0.4g。

练习册系列答案
相关题目