题目内容
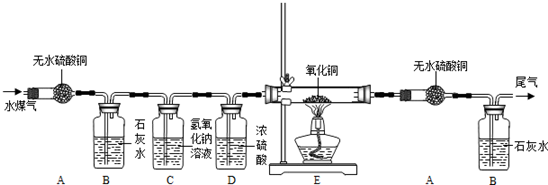
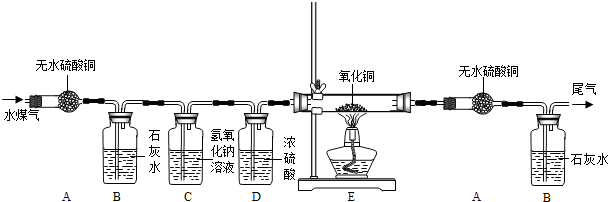
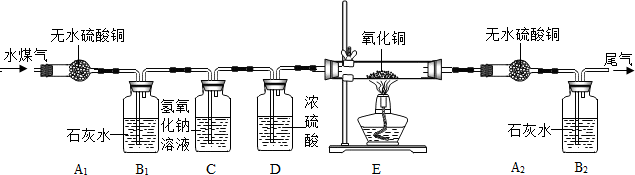
水煤气是将水蒸气通过灼热的焦炭而生成的气体,主要成分是一氧化碳、氢气及少量
的二氧化碳和水蒸气.某课题组同学为验证水煤气的成分,做了以下准备:
(一)资料收集:①H2+CuO
Cu+H2O ②CO+CuO
Cu+CO2 ③无水硫酸铜遇水由白色变为蓝色
(二)设计实验装置
请分析上面信息后回答:
①你认为验证水煤气中各成分的顺序依次是
A.H2O、CO2、H2、CO B.H2O、CO、H2、CO
C.CO、H2O、H2、CO2 D.CO、H2、CO、H2O
②装置C的目的是
③实验中两次用到装置B,前一次的目的是
④实验中两次用到装置A,后一次的作用是
⑤装置E内观察到的现象是
的二氧化碳和水蒸气.某课题组同学为验证水煤气的成分,做了以下准备:

(一)资料收集:①H2+CuO
| ||
| ||
(二)设计实验装置
请分析上面信息后回答:
①你认为验证水煤气中各成分的顺序依次是
A
A
(选填序号);A.H2O、CO2、H2、CO B.H2O、CO、H2、CO
C.CO、H2O、H2、CO2 D.CO、H2、CO、H2O
②装置C的目的是
除去水煤气中的二氧化碳
除去水煤气中的二氧化碳
,装置D的作用是除去水煤气中的水蒸气
除去水煤气中的水蒸气
;③实验中两次用到装置B,前一次的目的是
验证水煤气中二氧化碳的存在
验证水煤气中二氧化碳的存在
;④实验中两次用到装置A,后一次的作用是
检验水煤气中是否含有氢气
检验水煤气中是否含有氢气
.⑤装置E内观察到的现象是
黑色的氧化铜变成红色
黑色的氧化铜变成红色
.分析:①根据水能使白色硫酸铜变蓝,二氧化碳能使澄清石灰水变浑浊,氢气还原氧化铜能生成水,一氧化碳还原氧化铜生成二氧化碳考虑本题.
②根据氢氧化钠能与二氧化碳反应,浓硫酸具有吸水性考虑.
③根据二氧化碳能使澄清石灰水变浑浊考虑本题.
④根据水能使无水硫酸铜变成蓝色分析回答.
⑤氧化铜被还原成铜考虑实验现象
②根据氢氧化钠能与二氧化碳反应,浓硫酸具有吸水性考虑.
③根据二氧化碳能使澄清石灰水变浑浊考虑本题.
④根据水能使无水硫酸铜变成蓝色分析回答.
⑤氧化铜被还原成铜考虑实验现象
解答:解:①水能使白色硫酸铜变蓝,先通过无水硫酸铜是检验是否含有水的;二氧化碳能使澄清石灰水变浑浊,再通过石灰水是检验是否含有二氧化碳的;再通过氢氧化钠是除去原来的二氧化碳气体,通过浓硫酸是除去原来的水蒸气,通过氧化铜是检验是否含有还原性气体,再通过无水硫酸铜,是看是否有水生成,因为氢气还原氧化铜生成铜和水,所以是为了检验是否有氢气的;最后通过澄清石灰水是看有没有二氧化碳生成,由于一氧化碳还原氧化铜生成铜和二氧化碳,所以是为了检验是否含有一氧化碳的.综上所述,验证水煤气中各成分的顺序依次是H2O、CO2、H2、CO,所以A正确,B、C、D错误.
②氢氧化钠与二氧化碳反应生成碳酸钠和水,所以装置C的目的是:除去水煤气中的二氧化碳,排除对一氧化碳检验的干扰;由于浓硫酸具有吸水性,所以,装置D的作用是:除去水煤气中的水蒸气,排除对氢气检验的干扰.
③由于二氧化碳能时澄清的石灰水变浑浊,实验中两次用到装置B,第一次使用装置B目的是验证水煤气中二氧化碳的存在,第二次使用装置B目的是通过验证二氧化碳的存在证明水煤气中含有一氧化碳;
④由于水能使无水硫酸铜变成蓝色,实验中两次用到装置A,后一次的作用是:检验水煤气中是否含有氢气
⑤由于氧化铜被还原成铜.所以,装置E内观察到的现象是:黑色的氧化铜变成红色.
故答案为:
①A;②除去水煤气中的二氧化碳;除去水煤气中的水蒸气.③验证水煤气中二氧化碳的存在;④检验水煤气中是否含有氢气;⑤黑色的氧化铜变成红色.
②氢氧化钠与二氧化碳反应生成碳酸钠和水,所以装置C的目的是:除去水煤气中的二氧化碳,排除对一氧化碳检验的干扰;由于浓硫酸具有吸水性,所以,装置D的作用是:除去水煤气中的水蒸气,排除对氢气检验的干扰.
③由于二氧化碳能时澄清的石灰水变浑浊,实验中两次用到装置B,第一次使用装置B目的是验证水煤气中二氧化碳的存在,第二次使用装置B目的是通过验证二氧化碳的存在证明水煤气中含有一氧化碳;
④由于水能使无水硫酸铜变成蓝色,实验中两次用到装置A,后一次的作用是:检验水煤气中是否含有氢气
⑤由于氧化铜被还原成铜.所以,装置E内观察到的现象是:黑色的氧化铜变成红色.
故答案为:
①A;②除去水煤气中的二氧化碳;除去水煤气中的水蒸气.③验证水煤气中二氧化碳的存在;④检验水煤气中是否含有氢气;⑤黑色的氧化铜变成红色.
点评:解答本题关键是要知道检验水用无水硫酸铜,检验二氧化碳用澄清石灰水,检验氢气是通过氧化铜看有没有水生成,检验一氧化碳是通过氧化铜看有没有二氧化碳生成.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目