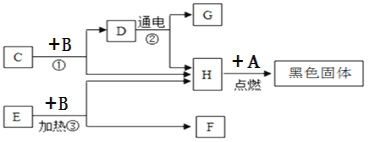
题目内容
【题目】下图是元素周期表中的一部分,请回答下列问题:
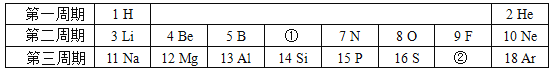
(1)上表中①所示元素的符号是______,②所示元素的单质的化学式是______。
(2)X3+与O2-的核外电子排布相同,则X的元素符号是_____,它处在元素周期表中第____周期,它与氧元素组成的化合物的名称是________。
(3)氟原子在化学反应中易____(填“得”或“失”)电子,所以氟元素在化合物中的化合价通常为______价。
【答案】C Cl2 Al 三 氧化铝 得 -1
【解析】
(1)根据元素周期表的一般规律可知①所示元素为质子数为6的碳元素,元素符号是C,②所示元素是质子数为17的氯元素,氯元素形成的单质是氯气,化学式是Cl2;
(2)X3+是X原子失去3个电子后形成的阳离子, O2-的是氧原子得到2个电子后形成的阴离子,二者核外电子排布相同,则X原子应该是具有三个电子层的铝原子,X的元素符号是Al,它处在元素周期表中第三周期,它与氧元素组成的化合物的名称是氧化铝;
(3)氟原子的最外层电子数是7,大于4,在化学反应中易得电子,所以氟元素在化合物中的化合价通常为-1价。

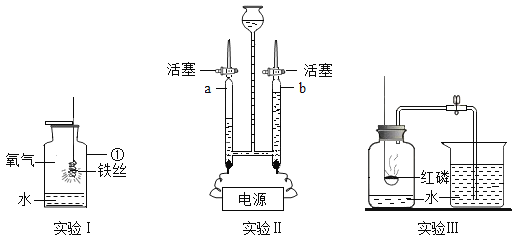
【题目】在老师的指导下,小华和小明利用如图1所示装置对氯酸钾制氧气进行了深入的探究学习。资料:
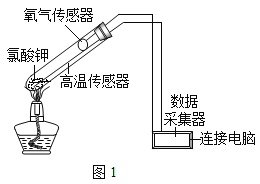
①氯酸钾的熔点约为356℃,二氧化锰的分解温度约为535℃。用酒精灯给物质加热,受热物质的温度一般约为400℃左右;
②不同配比是指氯酸钾和二氧化锰混合物中,氯酸钾和二氧化锰的质量比;
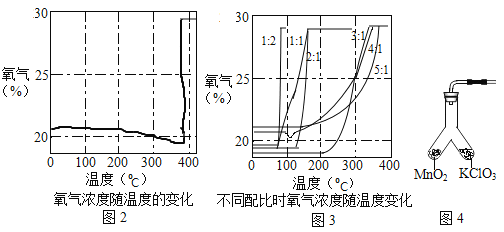
③氯酸钾分解时,传感器得到氧气浓度随温度的变化示意图(图2)及不同配比时氧气浓度随温度的变化示意图(图3)如下:
请回答问题:
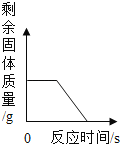
(1)分析图2,氯酸钾分解温度__________(填“高于”、“等于”或“低于”)其熔点。
(2)分析图2,在氯酸钾分解前,传感器得到氧气浓度降低的可能原因是___________
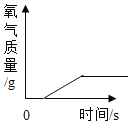
(3)分析图3,氯酸钾分解温度随物质配比变化的规律是___________,当物质配比为1:2时,氯酸钾分解温度约为________℃。
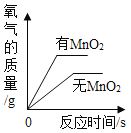
(4)为证实二氧化锰的催化作用,小华利用如图4装置进行如表所示的实验:
步骤 | 实验操作 | 实验现象 |
Ⅰ | 检查气密性。 | |
Ⅱ | 分别在“Y”形管两侧支管中加入少量二氧化锰和氯酸钾,塞紧橡皮塞。 | |
Ⅲ | 分别用酒精灯先后加热二氧化锰和氯酸钾,用带火星木条放在导管口。 | 加热左侧支管,可观察到_____, 加热右侧支管,可观察到_____。 |
Ⅳ | 冷却后,将“Y”形管左侧支管中部分二氧化锰混入右侧支管中,振荡“Y”形管,加热,用带火星木条放在导管口。 | 加热时间短于步骤Ⅲ,木条很快复燃 |
请回答:
①完善步骤Ⅲ中的填空:加热右侧支管,可观察到________________。
②小华认为根据步骤Ⅳ的实验现象就能说明二氧化锰是氯酸钾分解的催化剂,但小明不同意她的观点,小明认为还需证明在此反应中二氧化锰的__________和__________不变。后来在老师的指导下,小华完善了实验方案,最终验证了自己的结论,则氯酸钾制取氧气的符号表达式___________。
(5)根据氯酸钾的化学式KClO3计算:
①氯酸钾的相对分子质量 ______________
②12.25g氯酸钾中含氧元素 ____________g。