题目内容
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
________填“是”或“否”);理由是________;
写出铁或铝与表中的一种盐反应的化学方程式:
________
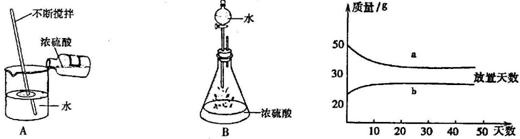
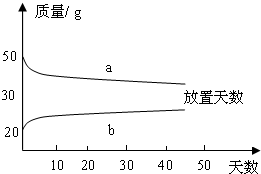
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.
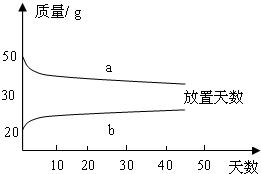
a、b曲线中表示浓硫酸的是(填字母序号)________;理由是________.
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH________kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |
解:(1)硝酸钠和氯化钡互换成分后没有沉淀、气体或水生成,不符合复分解反应发生的条件,所以该反应不能发生;铁会置换出硫酸铜或氯化铜中的铜.故答案为:否;硝酸钠和氯化钡互换成分后没有沉淀、气体或水生成,不符合复分解反应发生的条件;Fe+CuSO4=FeSO4+Cu(其他合理答案均可);
(2)浓硫酸会吸收空气中的水分而使质量增加,而浓盐酸会挥发出氯化氢气体而使质量减小.故答案为:b;浓硫酸吸收空气中的水分而使质量增大;
(3)①设需要NaOH的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 100kg×4.9%
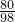 =
=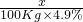
解得:x=4kg
②解:设改进后需要Ca(OH)2的质量为y.
Ca(OH)2+H2SO4═CaSO4+2H2O
74 98
y 100kg×4.9%
 =
=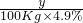
解得:y=3.7kg
∴可以节约经费:4kg×20.00元/kg-3.7kg×6.00元/kg=57.8元
分析:(1)根据复分解反应发生的条件进行分析,反应后必须有气体、沉淀或水生成,反应才能发生.置换反应要求是金属活动性顺序中前面的金属把后面的金属从它的盐溶液中置换出来;
(2)浓硫酸具有吸水性,质量会增大,浓盐酸具有挥发性,质量会减少;
(3)根据化学方程式中硫酸溶质的质量可以计算出所需氢氧化钠和氢氧化钙的质量,然后根据氢氧化钠和氢氧化钙的市场价格计算节约的经费;
点评:本题考查复分解反应发生的条件和根据化学方程式的计算,同时考查浓硫酸和浓盐酸的性质,并要求结合图象对应分析.
(2)浓硫酸会吸收空气中的水分而使质量增加,而浓盐酸会挥发出氯化氢气体而使质量减小.故答案为:b;浓硫酸吸收空气中的水分而使质量增大;
(3)①设需要NaOH的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 100kg×4.9%
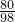 =
=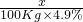
解得:x=4kg
②解:设改进后需要Ca(OH)2的质量为y.
Ca(OH)2+H2SO4═CaSO4+2H2O
74 98
y 100kg×4.9%
 =
=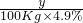
解得:y=3.7kg
∴可以节约经费:4kg×20.00元/kg-3.7kg×6.00元/kg=57.8元
分析:(1)根据复分解反应发生的条件进行分析,反应后必须有气体、沉淀或水生成,反应才能发生.置换反应要求是金属活动性顺序中前面的金属把后面的金属从它的盐溶液中置换出来;
(2)浓硫酸具有吸水性,质量会增大,浓盐酸具有挥发性,质量会减少;
(3)根据化学方程式中硫酸溶质的质量可以计算出所需氢氧化钠和氢氧化钙的质量,然后根据氢氧化钠和氢氧化钙的市场价格计算节约的经费;
点评:本题考查复分解反应发生的条件和根据化学方程式的计算,同时考查浓硫酸和浓盐酸的性质,并要求结合图象对应分析.

练习册系列答案
相关题目
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
判断:NaNO3与BaCl2溶液能否发生反应?
填“是”或“否”);理由是 ;
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.
a、b曲线中表示浓硫酸的是(填字母序号) ;理由是 .
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
判断:NaNO3与BaCl2溶液能否发生反应?
______填“是”或“否”);理由是______;
写出铁或铝与表中的一种盐反应的化学方程式:
______
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)______;理由是______.
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH______kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
______填“是”或“否”);理由是______;
写出铁或铝与表中的一种盐反应的化学方程式:
______
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)______;理由是______.
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH______kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
判断:NaNO3与BaCl2溶液能否发生反应?
______填“是”或“否”);理由是______;
写出铁或铝与表中的一种盐反应的化学方程式:
______
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)______;理由是______.
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH______kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
______填“是”或“否”);理由是______;
写出铁或铝与表中的一种盐反应的化学方程式:
______
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)______;理由是______.
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH______kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |