题目内容
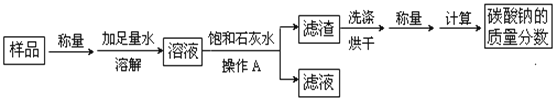
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
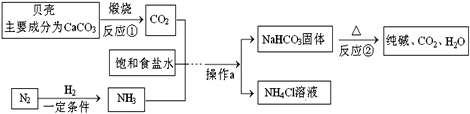
(1)反应①的化学方程式______________________,反应②的基本反应类型为_______。
(2)操作a的名称是_____________,实验室进行此操作所需的玻璃仪器有烧杯、玻璃棒、______。
(3)写出NH4Cl的一种用途________________。
【答案】CaCO3![]() CaO+CO2↑ 分解反应 过滤 漏斗 用作氮肥
CaO+CO2↑ 分解反应 过滤 漏斗 用作氮肥
【解析】
(1)反应①是碳酸钙在高温条件下分解生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
反应②中,碳酸氢钠分解生成碳酸钠、水和二氧化碳,反应的特征是一变多,属于分解反应.
故填:CaCO3![]() CaO+CO2↑;分解反应.
CaO+CO2↑;分解反应.
(2)操作a的名称是过滤,通过过滤把碳酸氢钠从溶液中分离出来,实验室进行此操作时所需的玻璃仪器有烧杯、玻璃棒、漏斗.
故填:过滤;漏斗.
(3)NH4Cl中含有氮元素,在农业上可以用作氮肥.
故填:作氮肥.

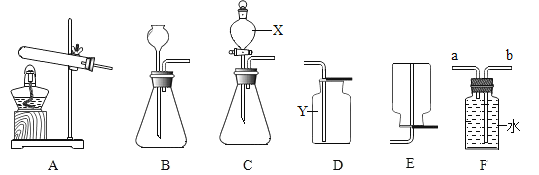
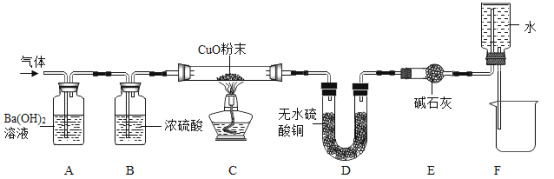
【题目】某小组对测定空气中氧气体积分数的实验进行了如下研究
(1)选用汞、磷、铜等物质均可以完成该实验,选择反应物的依据是________________.
a、反应物是固体b、在空气中反应且只消耗氧气
c、燃烧有明显现象d、生成物不是气体
(2)用甲、乙两套装置进行实验(红磷充足、装置不漏气).红磷燃烧的化学方程式是________________,有关分析合理的是________________.
a、都只能在实验结束后,推得氮气是无色气体
b、甲中燃烧匙伸入集气瓶太慢,测得空气中氧气的体积分数将偏大
c、乙中的瘪气球可以防止燃烧放热使橡胶塞弹出
d、乙比甲更节约能源
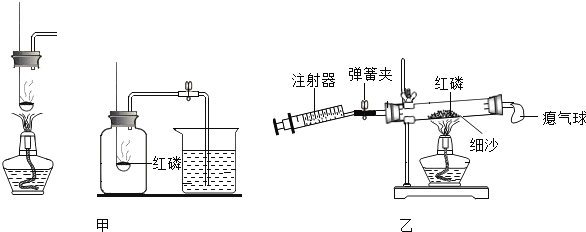
(3)利用乙装置实验时,先关闭弹簧夹,加热使红磷反应,待装置冷却至室温后打开弹簧夹.反应前后各数据及结论如下.
玻璃管中原有 空气的体积 | 注射器中气体的体积 | 结论 | |
反应前 | 反应后 | ||
________mL | 40ml | 30ml | 氧气约占空气体积的五分之一 |
(4)乙装置气密性检查方法________________________
(5)注射器中气体最好是________________。按理论值计算,反应后注射器中气体体积应该(填大于、小于、等于____________30ml