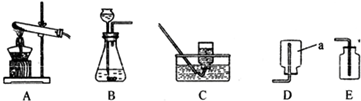
题目内容
某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.
| 制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 氯酸钾和二氧化锰 | ||
| 二氧化碳(干燥) | 大理石和稀盐酸 |
K2时,利用I、Ⅱ装置可直接进行的实验是______(填序号).

①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______;她的改进措施是______.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是______,可以观察到的现象是______.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是______(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为______.
③过滤、蒸发时都需用到的仪器是______(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是______.
解:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,我们可选用B作为发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,可选C或D作为收集装置;反应式是:2KMnO4 K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
具体内容如下表:
(2)根据装置I、Ⅱ的导管进出口顺序可知,装置Ⅱ只能用来收集难溶于水或密度比空气小的气体,因此利用装置I、Ⅱ可收集H2.故选②;
(3)反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠,此反应的化学式是:2Na2O2+2H2O═4NaOH+O2↑;因氧气不易溶于水,可用排水法收集,改进措施是:将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气);
故答案为:2Na2O2+2H2O═4NaOH+O2;将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气).
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝.故答案为:无水硫酸铜、白色粉末变成蓝色;
(5)①从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收
MnO2;
②氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为:50×5%=2.5g;
③在过滤、蒸发操作中都要用到玻璃棒,过滤实验中要用玻璃棒引流;蒸发实验中要用玻璃棒搅拌.
故答案为:①bcda;②2.5g;③C(顺序颠倒、不带单位均不给分);
(6)根据反应式计算:
设:假设6.5g金属都是锌时,可生成氢气Xg
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5 X
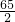 =
=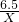
X=0.2g
可知6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu.故答案为:Cu.
分析:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,据此选择发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,选择收集装置;然后写出化学反应式即可;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,据此选择发生装置;根据二氧化碳密度大于空气的密度,易溶于水,选择收集装置;又因为要收集干燥的二氧化碳,所以要连接装置E;
(2)观察图示可知是固液在常温下的反应,并且收集气体的密度应小于空气的密度,然后选择即可;
(3)根据反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠写出化学反应式即可;因氧气不易溶于水,可用排水法收集.
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝;
(5)从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收MnO2;在过滤、蒸发操作中都要用到玻璃棒;
(6)若6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在.再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,做出推断.
点评:本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作、化学计算等知识.要同学们具有综合的化学知识方可做好此题.
 K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.具体内容如下表:
| 制取气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
| BC或BD | 2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ | ||
| AED | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
(3)反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠,此反应的化学式是:2Na2O2+2H2O═4NaOH+O2↑;因氧气不易溶于水,可用排水法收集,改进措施是:将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气);
故答案为:2Na2O2+2H2O═4NaOH+O2;将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气).
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝.故答案为:无水硫酸铜、白色粉末变成蓝色;
(5)①从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收
MnO2;
②氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为:50×5%=2.5g;
③在过滤、蒸发操作中都要用到玻璃棒,过滤实验中要用玻璃棒引流;蒸发实验中要用玻璃棒搅拌.
故答案为:①bcda;②2.5g;③C(顺序颠倒、不带单位均不给分);
(6)根据反应式计算:
设:假设6.5g金属都是锌时,可生成氢气Xg
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5 X
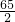 =
=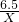
X=0.2g
可知6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu.故答案为:Cu.
分析:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,据此选择发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,选择收集装置;然后写出化学反应式即可;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,据此选择发生装置;根据二氧化碳密度大于空气的密度,易溶于水,选择收集装置;又因为要收集干燥的二氧化碳,所以要连接装置E;
(2)观察图示可知是固液在常温下的反应,并且收集气体的密度应小于空气的密度,然后选择即可;
(3)根据反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠写出化学反应式即可;因氧气不易溶于水,可用排水法收集.
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝;
(5)从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收MnO2;在过滤、蒸发操作中都要用到玻璃棒;
(6)若6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在.再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,做出推断.
点评:本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作、化学计算等知识.要同学们具有综合的化学知识方可做好此题.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是 ,碳酸钠的质量分数是 .(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质 (填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
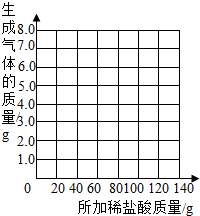
表中数据a= g,b= g.并请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |

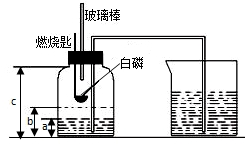 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: