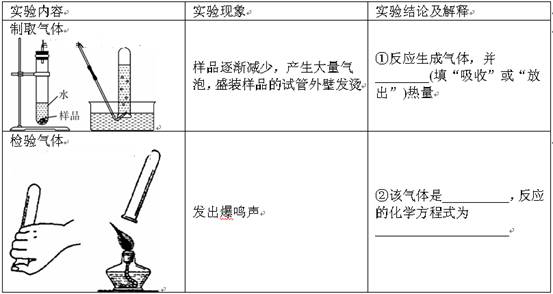
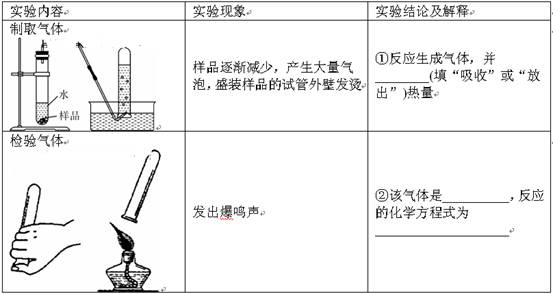
题目内容
(8分)某学习小组对市售“管道通”(排水管专用清洁剂)说明书的部分内容(如下图所示)产生兴趣,探究过程如下:
成 分:苛性钠、碳酸钠、铝粒、催化剂。
特 点:使用时,“管道通”样品倒入排水口,加水,瞬间释放高效泡沫,能溶解油脂、毛发、茶叶等,确保管道畅通。
注意事项:使用时不能碰明火,禁止与皮肤接触。
【提出问题】高效泡沫中含有什么气体?为什么使用时不能碰明火?
【猜 想】含有氢气。
(1)查阅资料得知:常温下,铝能与氢氧化钠溶液反应放出氢气。反应的化学方程式是2Al+2NaOH+2X===2NaAlO2+3H2↑,试推测X的化学式是________。
(2)取“管道通”样品进行下图所示实验。请在下表空格处填写相应内容: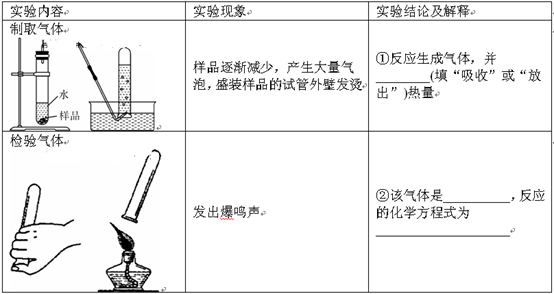
(3)“注意事项”中,“禁止与皮肤接触”是因为“管道通”成分中的________有强腐蚀性,使用时“不能碰明火”的理由是________________________________________________________________________。
(8分)(1)H2O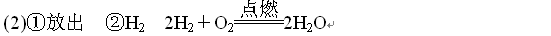
(3)苛性钠 H2和空气混合遇到明火发生爆炸
解析考点:实验探究物质的组成成分以及含量;常见碱的特性和用途;物质发生化学变化时的能量变化;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式;防范爆炸的措施;氢气的爆鸣实验.
专题:结合课本知识的信息;实验方法和过程的探究.
分析:(1)根据质量守恒定律的实质分析得出X的化学式;
(2)根据实验现象判断并结合氢气的性质完成解答,并写出反应的化学方程式;
(3)根据苛性钠具有强腐蚀性、可燃性气体及爆炸的条件来解答.
解答:解:(1)根据质量守恒定律可以知道反应前后原子的数目和种类不变来判断X的化学式,比较反应前后原子的种类和数目,可以知道反应前比反应后少了两个氧原子和四个氢原子,而反应前有2个X分子,故一个X分子中含有一个氧原子和两个氢原子,即X的化学式为H2O;
(2)根据第一步实验中试管的外壁发烫可以知道该反应放出了热量;根据第二步反应可以知道该气体为氢气,故该反应的化学方程式为:2H2+O2 2H2O;
2H2O;
(3)根据题给的物质可以知道具有强腐蚀性的为苛性钠,而氢气是可以燃烧的气体,在混有空气时遇到明火可能发生爆炸,所以对于可燃性气体或是粉尘必须严禁烟火.
答:(1)H2O;
(2)
(3)苛性钠;H2和空气混合遇到明火发生爆炸.实验内容 实验现象 实验结论及解释 制取气体 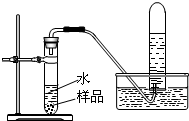
样品逐渐减少,产生大量气泡,盛装样品的试管外壁发烫 ①反应生成气体,并 放出(填“吸收”或“放出”)热量 检验气体 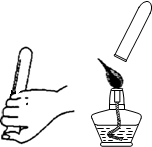
发出爆鸣声 ②该气体是 H2,反应的化学方程式为 2H2+O2 
2H2O
点评:能够从题给的信息中获取对解题有帮助的信息是我们必须具备的能力,同时知道可燃性气体和空气的混合气体我们称为爆鸣气,所以对于可燃性的气体必须严禁明火.

 阅读快车系列答案
阅读快车系列答案(9分)某学习小组对硫酸进行如下研究:
(1)已知相同温度下,硫酸的质量分数越大溶液的酸性越强。若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有 (填字母)。
A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
|
时间/h |
1 |
1.5 |
4 |
8 |
12 |
24 |
48 |
60 |
|
|
吸水质量/g |
硫酸甲 |
1.6 |
2.2 |
5.2 |
10.3 |
14.0 |
20.9 |
29.2 |
32.1 |
|
硫酸乙 |
1.2 |
1.5 |
3.5 |
5.9 |
8.1 |
12.9 |
19.5 |
21.0 |
(2)向两个烧杯中分别注入硫酸甲(溶质质量分数为98%,密度为1.84g/cm3)和硫酸乙(硫酸甲与水的按体积比1︰1混和)各10mL,称量并记录不同时间(h)两种硫酸溶液吸水的质量,数据见下表:
①若量取硫酸甲时俯视读数,则所配硫酸乙的溶质质量分数将 (填填“偏大”、“偏小”或“不变”。
②由表中实验数据可知:有关硫酸吸水性的说法不正确的是 (填字母)。
A.硫酸甲和乙都有吸水性 B.只有硫酸甲有吸水性 C.硫酸甲的吸水性较硫酸乙强(3)在高效复习课堂中,同学们利用稀释后的稀硫酸,硝酸钡、氢氧化钠、碳酸钾等物质的溶液对 “复分解反应发生的条件”进行再探究。
①将上述四种溶液两两混合,判断其两两之间能否发生反应,请写出其中符合下列条件的两个化学方程式:
一个中和反应 ;一个有沉淀生成的反应 。
②利用上述四种物质的溶液完成实验后,将所得物质混合并过滤,得到一种无色溶液。经测定,该溶液显酸性。则在该溶液中一定含有的离子是 。为了验证该溶液中可能含有的阴离子是否存在,请按如下实验进行验证。
|
溶液中可能含有的离子 |
设计实验验证(实验步骤、现象及对应的结论) |
|
|
|
 (2011?扬州)某学习小组对硫酸进行如下研究:
(2011?扬州)某学习小组对硫酸进行如下研究: