题目内容
阅读下列材料后,根据材料和提供的实验装置答题.2002年下半年以来,仅氯气泄漏造成伤亡的化工事故,就分别在湖南株洲,内蒙古乌海、四川双流、湖北武汉、重庆等城市发生数起.2004年4月16日,重庆天原化工厂再次发生重大氯气泄漏事故.
氯气,化学式:![]() .在通常情况下是一种黄绿色气体,密度比空气大,有毒.氯气溶解于水,溶解的氯气部分能够与水起反应,生成盐酸和次氯酸(化学式为:
.在通常情况下是一种黄绿色气体,密度比空气大,有毒.氯气溶解于水,溶解的氯气部分能够与水起反应,生成盐酸和次氯酸(化学式为:![]() ).次氯酸具有强氧化性,自来水中常通入氯气进行杀菌消毒.在实验室里,氯气可以用浓盐酸与二氧化锰在加热条件下起反应制取.
).次氯酸具有强氧化性,自来水中常通入氯气进行杀菌消毒.在实验室里,氯气可以用浓盐酸与二氧化锰在加热条件下起反应制取.

(1)①像天原化工厂这样有规模的老化工企业_________________继续留在主城区内(填“宜”或“不宜”);
②氯气与水反应的化学方程式:_________________.
(2)①不法商贩为牟取暴利,用自来水冒充蒸馏水,鉴别真伪的化学方程式有__________;
②上列实验装置中,可用作实验室制取氯气的发生装置是__________________,收集装置是_________________(以上填装置图下的代号),烧杯中盛NaOH溶液的作用是_________________,利用该装置制得的氯气中,还可能含有_________________ 气体.
答案:
解析:
提示:
解析:
| 答案:(1)①不宜 ② (2)① ②L,G,防止氯气逸出污染空气(或吸收尾气),氯化氢(或HCl).
|
提示:

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
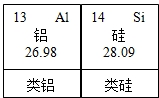
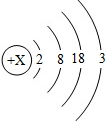
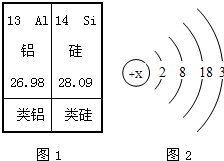 请仔细阅读下列材料:
请仔细阅读下列材料: