题目内容
 请仔细阅读下列材料:
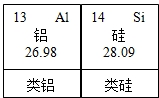
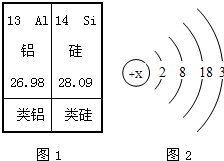
请仔细阅读下列材料:材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了元素周期表(如图1是其片断),并在他的元素周期表中留下了许多空位代表尚未发现的新元素,其中就预言了“类铝”这种新元素.
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g?cm-3,能与沸水剧烈反应生成氢气和氢氧化镓.不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9g?cm-3~6.0g?cm-3之间.
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g?cm-3,从而验证了元素周期表的正确性.随后科学家根据元素周期表的空位,按图索骥,发现了许多新元素.
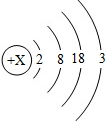
目前金属镓广泛用于制造半导体材料.镓的原子结构示意图如图2,常见化合价为+3.
根据你的理解回答下列问题:
(1)镓元素原子的质子数为
31
31
,其原子最外层电子数为3
3
;(2)请根据上述材料,总结金属镓的有关知识:
物理性质:
银白色,密度为5.94g.Cm-3
银白色,密度为5.94g.Cm-3
;化学性质(请用化学方程式表示):2Ga+6H2O=3H2↑+2Ga(OH)3
2Ga+6H2O=3H2↑+2Ga(OH)3
;用途:制造半导体材料
制造半导体材料
;(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸反应的化学方程式
2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O
2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O
.分析:(1)原子中,质子数=核外电子数,据此进行分析解答.
(2)物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等.
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸生成硫酸镓和水,写出反应的化学方程式即可.
(2)物质的化学性质是需要通过化学变化才能表现出来的性质,物理性质是不需要发生化学变化就能表现出来的性质,包括物质的颜色、状态、气味、熔点、沸点、密度、溶解性等,化学性质一般包括可燃性、氧化性、稳定性、还原性等.
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸生成硫酸镓和水,写出反应的化学方程式即可.
解答:解:(1)原子中,质子数=核外电子数,由镓的原子结构示意图可知,x=2+8=18+3=31;其原子最外层电子数为3.
(2)物理性质是不需要发生化学变化就能表现出来的性质,镓是银白色金属,密度4.7g?cm-3,不需要通过化学变化就能表现出来,属于物理性质.
能与沸水剧烈反应生成氢气和氢氧化镓,需要通过化学反应才能表现出来,属于化学性质,反应的化学方程式为:2Ga+6H2O=3H2↑+2Ga(OH)3.
目前金属镓广泛用于制造半导体材,属于金属镓的用途.
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸生成硫酸镓和水,反应的化学方程式为:2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O.
故答案为:(1)31;3;(2)银白色,密度为5.94g.Cm-3,2Ga+6H2O=3H2↑+2Ga(OH)3;制造半导体材料;(3)2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O.
(2)物理性质是不需要发生化学变化就能表现出来的性质,镓是银白色金属,密度4.7g?cm-3,不需要通过化学变化就能表现出来,属于物理性质.
能与沸水剧烈反应生成氢气和氢氧化镓,需要通过化学反应才能表现出来,属于化学性质,反应的化学方程式为:2Ga+6H2O=3H2↑+2Ga(OH)3.
目前金属镓广泛用于制造半导体材,属于金属镓的用途.
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸生成硫酸镓和水,反应的化学方程式为:2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O.
故答案为:(1)31;3;(2)银白色,密度为5.94g.Cm-3,2Ga+6H2O=3H2↑+2Ga(OH)3;制造半导体材料;(3)2Ga(OH)3+3H2SO4=Ga2(SO4)3+6H2O.
点评:本题难度不大,掌握元素周期表中元素的信息、原子结构示意图的意义、物理性质与化学性质的区别方法、化学方程式的书写等是正确解答本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目