题目内容
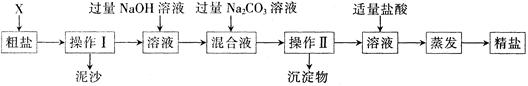
(7分)某校化学兴趣小组用氯化钠固体(含少量CaCl2杂质)来配制一定质量分数的NaCl溶液,实验的流程图如下:

请回答:
(1)写出过量的碳酸钠溶液加入到溶液A中所发生反应的化学方程式为 。
(2)操作2的名称是__ __,操作1、2、3都要用到的一种仪器是__ ,它在操作1中所起的作用是_ _。
(3)在溶液B中加入适量稀盐酸的目的是___ __。
(4)用上述实验所得的NaCl固体配制100.0g 溶质质量分数为5%的NaCl溶液,配制时某同学由于操作失误导致溶液中溶质的质量分数偏大,请你指出该同学引起失误的可能原因是 。

请回答:
(1)写出过量的碳酸钠溶液加入到溶液A中所发生反应的化学方程式为 。
(2)操作2的名称是__ __,操作1、2、3都要用到的一种仪器是__ ,它在操作1中所起的作用是_ _。
(3)在溶液B中加入适量稀盐酸的目的是___ __。
(4)用上述实验所得的NaCl固体配制100.0g 溶质质量分数为5%的NaCl溶液,配制时某同学由于操作失误导致溶液中溶质的质量分数偏大,请你指出该同学引起失误的可能原因是 。
(1)CaCl2 + Na2CO3 ="==" CaCO3↓+ 2NaCl(2分)
(2)过滤;玻璃棒;搅拌,加快固体的溶解 (3)除去过量的碳酸钠
(4)将水倒入烧杯时,不慎洒出等(其它合理答案也可)
(2)过滤;玻璃棒;搅拌,加快固体的溶解 (3)除去过量的碳酸钠
(4)将水倒入烧杯时,不慎洒出等(其它合理答案也可)
(1)溶液A中的成分有氯化钙、氯化钠等,Na2CO3会与氯化钙反应,方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
(2)除去水中不溶性的杂质的方法是过滤,操作1、2、3分别是溶解、过滤、蒸发,都要用到的一种仪器是玻璃棒,它在溶解中的作用是搅拌,加快固体的溶解;
(3)把过量碳酸钠加入A溶液中后,生成碳酸钙沉淀和氯化钠溶液,要把碳酸钙除去,可以用过滤的方法,所加盐酸是为了把B中的过量的碳酸钠除去;
(4)配制一定质量分数的溶液时,导致溶液中溶质的质量分数偏大的有:将水倒入烧杯时,不慎洒出;量取液体时俯视度数等等。
(2)除去水中不溶性的杂质的方法是过滤,操作1、2、3分别是溶解、过滤、蒸发,都要用到的一种仪器是玻璃棒,它在溶解中的作用是搅拌,加快固体的溶解;
(3)把过量碳酸钠加入A溶液中后,生成碳酸钙沉淀和氯化钠溶液,要把碳酸钙除去,可以用过滤的方法,所加盐酸是为了把B中的过量的碳酸钠除去;
(4)配制一定质量分数的溶液时,导致溶液中溶质的质量分数偏大的有:将水倒入烧杯时,不慎洒出;量取液体时俯视度数等等。

练习册系列答案
相关题目