题目内容
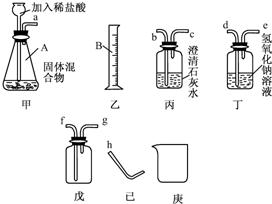
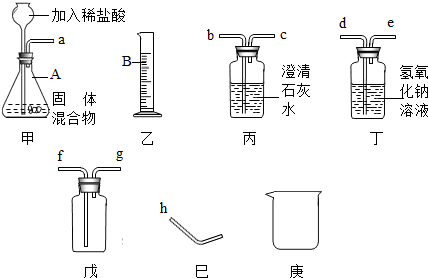
某固体混合物可能含有Zn、CaCO3、Na2CO3三种物质,为检测出该混合物中的具体物质及含量,探究小组选择了图中的部分装置,经过实验得知气体产物中含有氢气和二氧化碳.(提示:不考虑稀盐酸的挥发性)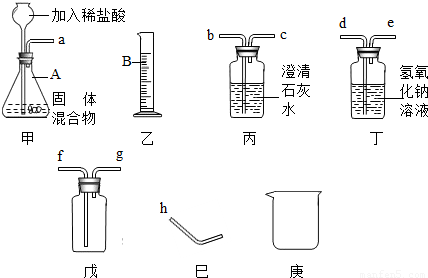
回答下列问题:
(1)装置甲中仪器A的名称是______,乙中仪器B的名称是______.
(2)长颈漏斗须伸入液面下的原因是______.
(3)装置戊若用于排空气法收集某种气体,当气体从g处进入,则可收集到密度比空气______的气体(填“大”或“小”).
(4)根据图中所提供的仪器装置,进行合理的连接,可完成以下指定的实验:
①证明该混合物中含有碳酸盐,从左到右的接口顺序为a→______.写出除装置甲内的反应外,该项实验中所发生反应的化学方程式:______.
②证明该混合物中含有锌粉,从左到右接口顺序为a→______.若在装置气密性良好的情况下,未观察到预期的实验现象,可能的原因是______.
(5)假如固体混合物中不含CaCO3,在实验中称取m克的样品(允许采用上述装置以外的仪器,但装置甲必须使用),甲同学说可以通过测量氢气体积,然后换算成氢气质量的方法计算出Zn的质量.乙同学说,他也可以用另一种方法获得锌的质量,他的方法是______.
【答案】分析:(1)根据仪器图,辨识常见仪器并正确写出仪器的名称;
(2)长颈漏斗不象分液漏斗没有可控制的活塞,产生的气体可以通过长颈漏斗而从装置中逸散,因此,需要把长颈漏斗伸入到液面以下,封住长颈漏斗而使气体不能从此逸出;
(3)排空气收集气体时,需要考虑气体的密度;气体密度大的向上排空气收集,密度小的则向下排空气收集;气体从g进入时,瓶内空气就只能从f排出,这就相当于空气从下面排出,类似于向下排空气;
(4)①混合物中的碳酸盐与盐酸反应产生二氧化碳,可使用澄清石灰水检验二氧化碳,因此,应把产生的气体通过装有澄清石灰水的丙装置,气体应从b管通入;
②混合物中的锌能与盐酸产生氢气,可使用点燃的方法检验氢气;因此需先把产生的混合气体中的二氧化碳通过丙装置的检验再通过丁装置进行完全吸收,把除去二氧化碳的气体使用玻璃管己进行点燃;如果气体处理不完全,氢气就会因混有二氧化碳而不能燃烧;
(5)根据产生气体的质量可计算出混合物中锌和碳酸钠的质量,也可以利用混合物与其中一种物质的质量差求得另一物质的质量;因此,可通过丙、丁装置测定二氧化碳的质量,由二氧化碳质量计算碳酸钠的质量,最后,用样品质量与碳酸钠的质量差求得金属锌的质量.
解答:解:(1)装置甲中仪器A用于向装置内添加液体药品的长颈漏斗;乙中仪器B为量取液体体积的量筒;
故答案为:锥形瓶;量筒;
(2)长颈漏斗伸入液面以下可以防止气体从长颈漏斗逸出装置,即液封;
故答案为:防止气体从长颈漏斗逸出(或液封);
(3)当气体从g处进入而使瓶内空气从处于下部的f导管排出,此为向下排空气收集气体的方法,故此气体的密度小于空气;
故答案为:小;
(4)①混合物中的碳酸盐与盐酸产生二氧化碳气体,因此,可把产生的气体通入澄清石灰水,石灰水变浑浊,说明产生气体中含二氧化碳而证明混合物中含有碳酸盐;
故答案为:b;CO2+Ca(OH)2=CaCO3↓+H2O;
②混合物中的金属锌能与盐酸反应产生氢气,因此需要检验生成的混合气体里含有氢气;可使用点燃的方法检验氢气的存在,需要先把气体通过丙、丁装置除去混合气体中的二氧化碳,然后利用己装置把气体点燃;如果气流过急,混合气体中的二氧化碳不能完全除去时,会影响氢气的燃烧;
故答案为:b→c→d→e→h;混合气体中的二氧化碳没有除尽;
(5)利用定量的方法测定混合物的成分的质量;可通过称量丙、丁装置测出生成二氧化碳的质量,根据反应的偿方程式计算出混合物中碳酸钠的质量,再对比所取样品质量与碳酸钠的质量,则可确定混合物中锌的质量;
故答案为:称出丙、丁装置在反应前后的质量,求出质量差即为CO2的质量;根据CO2的质量可计算出Na2CO3的质量,再由样品质量与Na2CO3的质量可得锌的质量.
点评:碳酸盐与酸反应产生气体二氧化碳,可通过澄清石灰水检验二氧化碳气体,而证明碳酸盐的存在;实验室常使用这种方法证明碳酸盐.
(2)长颈漏斗不象分液漏斗没有可控制的活塞,产生的气体可以通过长颈漏斗而从装置中逸散,因此,需要把长颈漏斗伸入到液面以下,封住长颈漏斗而使气体不能从此逸出;
(3)排空气收集气体时,需要考虑气体的密度;气体密度大的向上排空气收集,密度小的则向下排空气收集;气体从g进入时,瓶内空气就只能从f排出,这就相当于空气从下面排出,类似于向下排空气;
(4)①混合物中的碳酸盐与盐酸反应产生二氧化碳,可使用澄清石灰水检验二氧化碳,因此,应把产生的气体通过装有澄清石灰水的丙装置,气体应从b管通入;
②混合物中的锌能与盐酸产生氢气,可使用点燃的方法检验氢气;因此需先把产生的混合气体中的二氧化碳通过丙装置的检验再通过丁装置进行完全吸收,把除去二氧化碳的气体使用玻璃管己进行点燃;如果气体处理不完全,氢气就会因混有二氧化碳而不能燃烧;
(5)根据产生气体的质量可计算出混合物中锌和碳酸钠的质量,也可以利用混合物与其中一种物质的质量差求得另一物质的质量;因此,可通过丙、丁装置测定二氧化碳的质量,由二氧化碳质量计算碳酸钠的质量,最后,用样品质量与碳酸钠的质量差求得金属锌的质量.
解答:解:(1)装置甲中仪器A用于向装置内添加液体药品的长颈漏斗;乙中仪器B为量取液体体积的量筒;
故答案为:锥形瓶;量筒;
(2)长颈漏斗伸入液面以下可以防止气体从长颈漏斗逸出装置,即液封;
故答案为:防止气体从长颈漏斗逸出(或液封);
(3)当气体从g处进入而使瓶内空气从处于下部的f导管排出,此为向下排空气收集气体的方法,故此气体的密度小于空气;
故答案为:小;
(4)①混合物中的碳酸盐与盐酸产生二氧化碳气体,因此,可把产生的气体通入澄清石灰水,石灰水变浑浊,说明产生气体中含二氧化碳而证明混合物中含有碳酸盐;
故答案为:b;CO2+Ca(OH)2=CaCO3↓+H2O;
②混合物中的金属锌能与盐酸反应产生氢气,因此需要检验生成的混合气体里含有氢气;可使用点燃的方法检验氢气的存在,需要先把气体通过丙、丁装置除去混合气体中的二氧化碳,然后利用己装置把气体点燃;如果气流过急,混合气体中的二氧化碳不能完全除去时,会影响氢气的燃烧;
故答案为:b→c→d→e→h;混合气体中的二氧化碳没有除尽;
(5)利用定量的方法测定混合物的成分的质量;可通过称量丙、丁装置测出生成二氧化碳的质量,根据反应的偿方程式计算出混合物中碳酸钠的质量,再对比所取样品质量与碳酸钠的质量,则可确定混合物中锌的质量;
故答案为:称出丙、丁装置在反应前后的质量,求出质量差即为CO2的质量;根据CO2的质量可计算出Na2CO3的质量,再由样品质量与Na2CO3的质量可得锌的质量.
点评:碳酸盐与酸反应产生气体二氧化碳,可通过澄清石灰水检验二氧化碳气体,而证明碳酸盐的存在;实验室常使用这种方法证明碳酸盐.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目