题目内容
 (2009?眉山)请仔细观察下图,回答下列问题:
(2009?眉山)请仔细观察下图,回答下列问题:(1)从图中你可得到:同一元素的化合价在反应前后的变化规律是______.
(2)已知浓硫酸与铜在加热条件下可发生化学反应.甲、乙两同学对该反应的生成物有不同观点.甲同学认为生成物为CuSO4和H2O,乙同学认为生成物为CuSO4、SO2和H2O.请结合信息书写出你认为正确的反应方程式______ CuSO4+SO2↑+2H2O
【答案】分析:(1)利用氢气还原氧化铜的方程式,各元素的化合价变化解决.
(2)由(1)分析知道一个反应中有元素化合价升高必有元素化合价降低,故反应只能是生成CuSO4、SO2和H2O的反应.
解答:解:(1)在氢气还原氧化铜的反应中,铜元素化合价降低了,氢元素化合价升高了,氧元素化合价未变化.
故答案为:升高(或降低或不变)
(2)在(1)中分析可以看出一个氧化还原反应中有元素化合价升高就得有元素化合价降低,且被还原的物质是化合价降低的物质,可知道此反应生成物是CuSO4、SO2和H2O,且硫元素由+6变成了+4,因此浓硫酸被还原.
故答案为:Cu+2H2SO4(浓)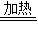 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
浓硫酸
点评:此题是对信息分析题,是对氧化还原反应的拓展延伸,能很好的对学生进行综合分析能力的培养.
(2)由(1)分析知道一个反应中有元素化合价升高必有元素化合价降低,故反应只能是生成CuSO4、SO2和H2O的反应.
解答:解:(1)在氢气还原氧化铜的反应中,铜元素化合价降低了,氢元素化合价升高了,氧元素化合价未变化.
故答案为:升高(或降低或不变)
(2)在(1)中分析可以看出一个氧化还原反应中有元素化合价升高就得有元素化合价降低,且被还原的物质是化合价降低的物质,可知道此反应生成物是CuSO4、SO2和H2O,且硫元素由+6变成了+4,因此浓硫酸被还原.
故答案为:Cu+2H2SO4(浓)
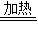 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;浓硫酸
点评:此题是对信息分析题,是对氧化还原反应的拓展延伸,能很好的对学生进行综合分析能力的培养.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
(2009?眉山)请分别用一种试剂除去下列各物质中的杂质(假设所选试剂与杂质恰好完全反应).
| 物质 | 杂质 | 除杂质所用的试剂(填化学式) | |
| (1) | CO | CO2 | |
| (2) | NaCl | Na2CO3 | |
| (3) | C | CuO | |
| (4) | KCl | Fe2(SO4)3 |
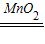 2H2O+O2↑)
2H2O+O2↑)
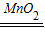 2H2O+O2↑)
2H2O+O2↑)