题目内容
(2009?眉山)某化学兴趣小组的同学为了体验“工业冶炼金属”的过程.在实验室做了CO还原CuO的实验,他们称得装有CuO粉末的试管重42g,反应完全后,恢复到室温称量,试管和固体残留物共重40.4g,并收集到CO24.4g,请你和他们一起计算:(1)42g-40.4g=1.6g,1.6g表示______的质量.
(2)该反应制得铜的质量为多少克?
【答案】分析:该题的关键是理解冶炼金属的原理:CO+CuO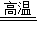 Cu+CO2,CO夺得氧生成CO2,CuO失去氧生成Cu,因此固体质量减少量为参加反应的氧化铜失去的氧的质量.依据题意还知道收集到的CO2 的质量,所以计算铜的质量时,可以根据氧元素的质量和氧化铜的化学式进行计算,也可根据CO2的质量和化学方程式进行计算.
Cu+CO2,CO夺得氧生成CO2,CuO失去氧生成Cu,因此固体质量减少量为参加反应的氧化铜失去的氧的质量.依据题意还知道收集到的CO2 的质量,所以计算铜的质量时,可以根据氧元素的质量和氧化铜的化学式进行计算,也可根据CO2的质量和化学方程式进行计算.
解答:解:(1)试管与内装的氧化铜粉末共重42g,反应中氧化铜失去氧而生成铜,试管与生成的铜共重40.4g,所以固体减少量为42g-40.4g=1.6g,则1.6g表示 反应的CuO中氧元素的质量.
(2)方法一:根据质量守恒定律可知,反应中制的铜就是反应的氧化铜中的铜,可根据氧化铜的化学式,铜与氧元素的质量比进行计算.
设铜的质量为X,则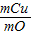 =
=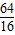 =
=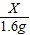
解得:X=6.4g
答、反应制得的铜的质量为6.4g.
方法二:解,设制的铜的质量为X
CO+CuO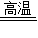 Cu+CO2
Cu+CO2
64 44
X 4.4g
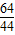 =
=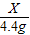
解得:x=6.4g
答:可制的铜的质量为6.4g.
点评:该题主要考查有关化学式和化学方程式的计算,解答该题的关键分析实验数据,把握有效数值,选择的数据不同,计算方法不同.
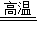 Cu+CO2,CO夺得氧生成CO2,CuO失去氧生成Cu,因此固体质量减少量为参加反应的氧化铜失去的氧的质量.依据题意还知道收集到的CO2 的质量,所以计算铜的质量时,可以根据氧元素的质量和氧化铜的化学式进行计算,也可根据CO2的质量和化学方程式进行计算.
Cu+CO2,CO夺得氧生成CO2,CuO失去氧生成Cu,因此固体质量减少量为参加反应的氧化铜失去的氧的质量.依据题意还知道收集到的CO2 的质量,所以计算铜的质量时,可以根据氧元素的质量和氧化铜的化学式进行计算,也可根据CO2的质量和化学方程式进行计算.解答:解:(1)试管与内装的氧化铜粉末共重42g,反应中氧化铜失去氧而生成铜,试管与生成的铜共重40.4g,所以固体减少量为42g-40.4g=1.6g,则1.6g表示 反应的CuO中氧元素的质量.
(2)方法一:根据质量守恒定律可知,反应中制的铜就是反应的氧化铜中的铜,可根据氧化铜的化学式,铜与氧元素的质量比进行计算.
设铜的质量为X,则
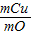 =
=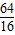 =
=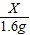
解得:X=6.4g
答、反应制得的铜的质量为6.4g.
方法二:解,设制的铜的质量为X
CO+CuO
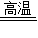 Cu+CO2
Cu+CO264 44
X 4.4g
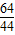 =
=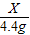
解得:x=6.4g
答:可制的铜的质量为6.4g.
点评:该题主要考查有关化学式和化学方程式的计算,解答该题的关键分析实验数据,把握有效数值,选择的数据不同,计算方法不同.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
(2009?眉山)某天然矿泉水的主要成份如下,请认真阅读后填空.
(1)“SO42-”中数字“2”的含义是______.
(2)该矿泉水显______性(填“酸”、“碱”或“中”).
(3)日常生活中用______区别软水和硬水,可通过______方法降低水的硬度.
| 主要成分(mg/L): 碳酸氢根(HCO3-):173-205 氯离子(Cl-):1.0-8.0 硫酸根(SO42-):16.08 -19.52 钠离子(Na+):8-50 PH值:7.8±0.5 |
(2)该矿泉水显______性(填“酸”、“碱”或“中”).
(3)日常生活中用______区别软水和硬水,可通过______方法降低水的硬度.