题目内容
【题目】氧气在自然界中存在非常广泛,如图是氧气的性质和制备的网络图和装置图:
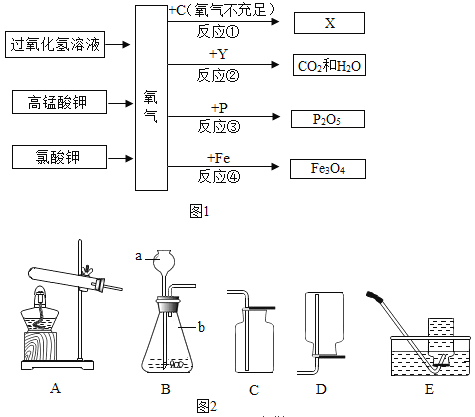
(1)若反应②的符号表达式为: ![]() ,则Y可能是___________(写一种物质的名称)。
,则Y可能是___________(写一种物质的名称)。
(2)反应①~④的相同点是____________(写一条即可,下同),氧气的用途有_______________。
(3)从节能、环保等角度考虑.实验室制取氧气最好选用过氧化氢溶液作反应物。采用的装置组合是_______(填字母序号)。
(4)工业上还可以采用分离液态空气的方法制氧气。该方法分离氧气和氮气的依据是_____________。将空气变为液态的方法可以是_____________。
(5)某化学小组取16 g高锰酸钾制取氧气,反应一段时间后,冷却,称得试管剩余固体质量为14.4g。他们计算出生成氧气的质量为1.6g,计算的理论依据是_____________,该过程中高锰酸钾的分解率为_________(保留1位小数)。
【答案】甲烷(或乙醇)(符合题意均可) 都是氧化反应(或都放热,产物都是氧化物等,合理均可) 作助燃剂等 BC(或BE ) 两者沸点不同 降温、加压(答对其中一种即可) 质量守恒定律 98.8%
【解析】
(1)反应②的符号表达式为:![]() ,根据质量守恒定律,元素种类不变,Y一定含有碳元素和氢元素,可能含有氧元素,则Y可能是甲烷或乙醇等。
,根据质量守恒定律,元素种类不变,Y一定含有碳元素和氢元素,可能含有氧元素,则Y可能是甲烷或乙醇等。
(2)反应①~④都是物质与氧气反应生成氧化物,相同点是都是氧化反应;氧气的用途有作助燃剂。
(3)用过氧化氢溶液作反应物来制取氧气,反应原理是固体和液体不需加热型,发生装置应选择B,氧气的密度比空气的大且不易溶于水,应用向上排空气法或排水法收集,收集装置选择C或E。故可采用的装置组合是BC(或BE )。
(4)工业上还可以采用分离液态空气的方法制氧气。该方法分离氧气和氮气的依据是两者沸点不同。将空气变为液态的方法可以是降温、加压。
(5)取16 g高锰酸钾制取氧气,反应一段时间后,冷却,称得试管剩余固体质量为14.4g。依据质量守恒定律,则可计算出生成氧气的质量为16 g -14.4g =1.6g。
解:设该过程中分解的高锰酸钾的质量为X。
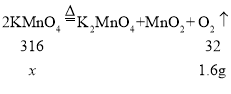

则该过程中高锰酸钾的分解率为![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】实验室存放盐溶液的柜子里,有一瓶无色溶液的标签因受到腐蚀而破损,如图所示。某兴趣小组同学对其成分进行探究。
(提出问题)这瓶是什么溶液呢?
(猜想与假设)经了解得知,这瓶无色溶液可能是
碳酸钾、硫酸钾、氯化钾、硝酸钾中的某一种溶液。
(推理分析)小组同学为了确定该溶液的成分,他们进行了以下
(1)甲同学根据物质的组成元素认为一定不可能是________溶液。
(2)乙同学认为也不可能是硝酸钾溶液,他的依据是______________。
(设计实验)为了确定该溶液究竟是剩余两种溶液中的哪一种,丙同学设计了如下实验:
实验操作 | 实验现象 | 实验结论 |
取少量该溶液于试管中,逐滴加入氯化钡溶液 | 产生白色沉淀 | 该溶液一定是碳酸钾溶液 |
(实验反思)
(1)丁同学认为丙的结论不合理,理由是___________________________。
(2)在丙同学实验的基础上,丁同学继续进行实验,实验方案如下:
实验操作 | 实验现象 | 实验结论 |
取丙同学实验所得的白色沉淀于试管中,滴加适量的_________,振荡 | _________,沉淀溶解 | 该溶液是碳酸钾溶液。 反应的化学方程式是_____ |
(3)为防止标签受到腐蚀,倾倒液体时应注意:____________________。