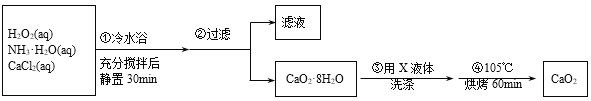
题目内容
【题目】现有家用食用碱12g(主要成分Na2CO3,其它成分不与酸反应),向其中加入某未知浓度的稀盐酸100g,恰好完全反应,剩余物质的总质量为107.6g,反应过程如图所示,请计算:

(1)该图中,m的值为______
(2)该食用碱中Na2CO3的质量_____
(3)该稀盐酸中溶质的质量分数_____.
【答案】4.4 10.6g 7.3%
【解析】
根据质量守恒定律,二氧化碳的质量为:100g+12g-107.6g=4.4g;
设该食用碱中Na2CO3的质量为x,稀盐酸中氯化氢的质量分数为y
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 44
X 100gy 4.4g
![]()
x=10.6g,y=7.3%
答:(1)该图中,m的值为 4.4;
(2)该食用碱中Na2CO3的质量为10.6g;
(3)该稀盐酸中溶质的质量分数为7.3%.

练习册系列答案
相关题目
【题目】“打好蓝天保卫战、治理大气污染”是提升人民生活质量的重要工作。二氧化硫(SO2)是一种大气污染物。工业上可以利用海水对二氧化硫进行吸收利用,变害为宝。其工艺流程见图:
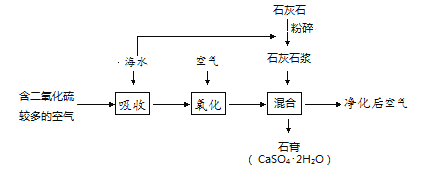
(1)流程中将石灰石加水制成石灰石浆的目的是_______。
(2)其中硫元素的化合价在反应前后的变化为________。.
(3)为了提升脱硫率(脱硫率是指已除去的二氧化硫的量占总二氧化硫量的百分比)与温度、烟气中SO2浓度的关系,技术人员进行了探究实验。实验结果如下:
实验序号 | 温度/℃ | 烟气中SO2浓度/10-2gL-1 | 脱硫率 |
Ⅰ | 23 | 2.5% | 99.5 |
Ⅱ | 23 | 3.2% | 97.1 |
Ⅲ | 40 | 2.5% | 94.3 |
由表中实验数据可得出的结论是_______。