题目内容
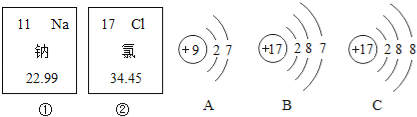
【题目】锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn(相对分子质量为455)。请回答:
(1)葡萄糖酸锌由_____组成,1个葡萄糖酸锌分子中含有_____个原子;
(2)葡萄糖酸锌中所含锌元素的质量分数为_____;(保留一位小数)
(3)现有一支20mL的葡萄糖酸锌口服液,其中含锌6.5mg,则这支口服液中葡萄糖酸锌的质量为_____mg。(保留一位小数)
【答案】四 49 14.3% 45.5
【解析】
(1)根据葡萄糖酸锌的化学式C12H22O14Zn可知,它由C、H、O、Zn四种元素组成;1个葡萄糖酸锌分子中含有原子数目=12+22+14+1=49;
(2)葡萄糖酸锌中所含锌元素的质量分数为:![]() ;
;
(3)这支口服液中葡萄糖酸锌的质量=![]() 。
。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】小丽对家中的家用制氧机产生了浓厚的兴趣。她通过阅读说明书了解到家用制氧机的工作原理如下:
(加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。减压时,分子筛将所吸附的氮气排放。整个过程中,分子筛并不消耗。)
小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气。
(实验记录)
实验步骤 | 实验现象 | 文字或化学式表达式 |
取一只250 mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 | 木炭燃烧得更旺 | 表达式1 |
表中,表达式1是_____。
(实验结论)收集的气体是纯净的氧气。
(实验反思)老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气。该实验不能证明所收集气体为纯净氧气的原因是_____。
实验II:测定小丽所带气体中氧气的含量。
同学们在老师的指导下设计了如下图所示装置,进行实验,并重复多次。
 (250 mL 集气瓶)
(250 mL 集气瓶)
(实验记录)
实验操作 | 主要实验现象 | 实验结论及解释 | |
① | 检查装置的气密性 | 装置的气密性良好 | |
② | 加入药品,将装置连接固定 | ||
③ | 打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b | A中水进入到B中,B中水的体积为200 mL。 | 收集200 mL气体(由压强差引起的误差忽略不计) |
④ | 用凸透镜聚光引燃白磷 | 现象1 | |
⑤ | 待白磷熄灭并冷却到室温, 打开止水夹b | 现象2 | 小丽收集的气体不是纯净的氧气 |
表中,现象1是_____;现象2是_____。
(数据记录)
实验次序 | 1 | 2 | 3 | 4 | 5 |
B中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
(数据处理)已知,在上表数据中,第1组数据偏差较大,存在明显误差,在数据处理时应删去。小丽所带气体中氧气的体积分数为_____% 。(取平均值)
(实验反思)
(1)这台家用制氧机制氧气的过程发生的变化属于_____(填“物理变化”或“化学变化”)。
(2)导致第1组数据产生较大误差的可能原因是_____。
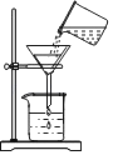
(3)气体压力传感器可用于检测密闭体系内的气压变化,并以数字、图像等多种形式形象地显示出来。某同学用压力传感器测出实验过程中集气瓶内气压-时间关系如图2所示。
问:①图2中BC段气压变化的原因是_____;
②导致DE段气压变化的实验操作是_____。
【题目】实验室常用的干燥剂有浓硫酸、碱石灰(CaO和NaOH的固体混合物)等,后者在潮湿的空气中易变质。某化学兴趣小组对实验室中一瓶久置的碱石灰展开探究。
[查阅资料]①碱石灰易吸收空气中的水蒸气和二氧化碳 ②氯化钙溶液呈中性,碳酸钠溶液呈碱性 ③碳酸钠和氢氧化钙溶于水温度变化不明显 ④Ca(OH)2分解温度为580℃,CaCO3分解温度为825℃,Na2CO3的分解温度为1744℃。
[提出问题]碱石灰是否变质?其成分可能有哪些?
[进行猜想]①若没有变质,碱石灰吸水性良好,成分只有CaO和NaOH;
②若变质,该碱石灰中可能含有CaO、NaOH、Ca(OH)2、Na2CO3、CaCO3中的两种或两种以上。
[实验过程]
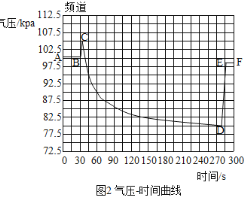
(1)验证碱石灰是否变质:图中的B为干燥装置,常用于固体干燥剂干燥气体。现用A、B装置检验碱石灰是否变质,取适量的无水硫酸铜和碱石灰样品分别装入A、B中,连接好A、B装置,从 ____(填“c”或“d”)端向B中缓缓通入水蒸气,观察A装置中的现象为____,证明碱石灰已变质。
(2)验证碱石灰是否完全变质:取适量碱石灰样品放入试管中,加入足量蒸馏水使其充分溶解,溶液变浑浊,用手触摸试管外壁,温度无明显变化,证明碱石灰已完全变质。则样品成分最多有___种可能性(填数字)。
(3)为进一步确定碱石灰样品的成分,该小组继续实验并记录如下:
实验编号 | 实验操作 | 实验目的、现象或数据 | 实验结论 |
实验一 | ①取适量样品于试管中,加入足量蒸馏水使其充分溶解; ②过滤,得到滤渣A和滤液B;③向滤液B中加入足量CaCl2溶液,静置; ④________。 | 操作③的主要目的是:___ 操作④的现象:____ | 样品中一定有Ca(OH)2 |
实验二 | ①取干燥样品50g,控制在600℃内,加热至质量不再发生变化,冷却后称量; ②将①中剩余固体控制在850℃内反复加热,冷却后称量。 | 操作①中称得固体质量为45.5g;操作②固体质量无变化。 | 样品中一定没有_____(填化学式) |
[探究结论] 通过整个探究活动分析得知碱石灰样品的成分是______(填化学式),其中盐的质量分数为_____。
[反思与评价] 通过探究活动,大家知道该碱石灰变质的化学反应过程,其中生成盐的化学方程式为______;明白了碱石灰要密封保存的原因。
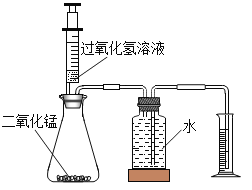
【题目】实验室常用过氧化氢溶液和二氧化锰(催化剂)制取氧气.
(提出问题)二氧化锰是催化剂,二氧化锰的用量对反应速率是否有影响?
(设计实验)(1)实验装置如图所示.
(2)实验记录:每次用30毫升10%的过氧化氢溶液,采用不同量二氧化锰粉末作催化剂进行实验,测定相关数据记录于下表中:
实验序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
待测数据 |
(分析)(1)上述实验应该测定的“待测数据”可能是_____________.
(2)10次实验“每次用30毫升10%的过氧化氢溶液”的目的是_____________.
p>(3)若第2次实验比第3次试验的“待测数据”更______________(填“大”或“小”),说明催化剂的用量越多,反应越快.(实验与结果)经多次实验证明,第1次实验至第7次实验中过氧化氢的分解速率依次加快,第7次实验至第10次实验所记录的“待测数据”无明显差异.
(结论)__________________.