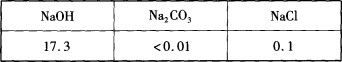题目内容
【题目】兴趣小组的同学为测定某一铁铜合金中含铁的质量分数,将6g该合金粉末样品,加入溶质质量分数为10%的硫酸铜溶液160 g中,二者恰好完全反应。同时为了充分利用资源,还对反应后的物质进行回收处理。请结合下面图示计算。(计算结果均保留小数点后一位有效数字)
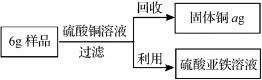
(1)该合金样品中含铁的质量分数;
(2)回收所得固体铜的质量。
【答案】(1)93.3% (2) 6.8克
【解析】
试题分析:参加反应的硫酸铜的质量为:160g×10% = 16g
设样品中铁的质量为x,生成铜的质量为y[。
Fe + CuSO4 = FeSO4 + Cu
56 160 64
x 16g y
列比例式得:56:X=160::16克=64:Y
解得:x=5.6gY=6.4克
(1)样品中含铁的质量分数是:5.6克/6克×100%=93.3%
回收所得固体铜的质量是:6.4g+(6g-5.6g) = 6.8g

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目