题目内容
【题目】(11分)人教版新课标化学教材九年级上册 “分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
【实验探究一】氧化铁能否作过氧化氢溶液分解的催化剂?如果能,催化效果如何?
实验步骤 | 实验现象 |
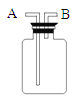
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
|
|
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
【实验结论】
①由实验Ⅰ你可以得出的结论是 ;
②实验Ⅱ、Ⅲ证明:氧化铁的 和 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
③写出氧化铁催化过氧化氢分解的化学方程式 。
【实验评价】
①实验设计Ⅳ的目的是 ;
②若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是: 。
【知识拓展】
①查阅资料可知:CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。
下列有关催化剂的说法中正确的是 。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其他反应的反应物或生成物
②马铃薯长期放置后会发芽,发芽马铃薯中含有一种致毒成分茄碱(C45H73O15N),又称马铃薯毒素,是一种弱碱性的甙生物碱,又名龙葵甙,大量食用未成熟或发芽马铃薯可引起急性中毒。试计算433.5g茄碱中含有的碳元素的质量(写出计算过程)。
【实验探究二】影响化学反应的速率除了催化剂以外,还有其它因素吗?以下是另一实验小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶 液浓度% | H2O2溶液体积/mL | 温度℃ | MnO2的用量/g | 收集氧气的体积/mL | 反应所需 的时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
通过实验①和②对比可知,化学反应速率还与 有关;
从实验 和 对比可知,温度越高,化学反应速率越快。
【答案】【实验结论】①氧化铁能改变过氧化氢分解的速率;②质量;化学性质;
③2H2O2![]() 2H2O + O2 ↑ 【实验评价】①探究氧化铁和二氧化锰的催化效果哪个好;②二氧化锰比氧化铁的催化效果好;【知识拓展】①B;②270g;【实验探究二】过氧化氢溶液的浓度;③④。
2H2O + O2 ↑ 【实验评价】①探究氧化铁和二氧化锰的催化效果哪个好;②二氧化锰比氧化铁的催化效果好;【知识拓展】①B;②270g;【实验探究二】过氧化氢溶液的浓度;③④。
【解析】
试题分析:【实验结论】①通过对比实验,说明氧化铁确实改变了过氧化氢分解的速率。②实验Ⅱ说明氧化铁仍能对过氧化氢的分解起加快作用,说明其化学性质没有发生改变。实验Ⅲ通过两次称量,说明其质量在反应前后并没有发生改变。③这个反应和二氧化锰作催化剂时的反应一样,只需将催化剂由二氧化锰转换成氧化铁即可。反应的化符号表达式为:2H2O2![]() 2H2O + O2↑;【实验评价】①实验设计Ⅳ的目的是探究氧化铁和二氧化锰的催化效果哪个好;②若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:二氧化锰比氧化铁的催化效果好;【知识拓展】根据催化剂的定义可知①下列有关催化剂的说法中正确的是,同一个化学反应可以有多种催化剂,故选择B;②433.5g茄碱中含有碳元素为:(12×45/867) ×100%×433.5g=270g【实验探究二】实验①和②中唯一的不同是过氧化氢溶液的浓度,所以我们可以得出反应速率还与反应物的浓度有关。要得出化学反应速率与温度的关系,只需找到温度不同而其他条件完全相同的两个实验作对比,观察表格,容易发现实验③和④对比符合温度越高,化学反应速率越快。
2H2O + O2↑;【实验评价】①实验设计Ⅳ的目的是探究氧化铁和二氧化锰的催化效果哪个好;②若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:二氧化锰比氧化铁的催化效果好;【知识拓展】根据催化剂的定义可知①下列有关催化剂的说法中正确的是,同一个化学反应可以有多种催化剂,故选择B;②433.5g茄碱中含有碳元素为:(12×45/867) ×100%×433.5g=270g【实验探究二】实验①和②中唯一的不同是过氧化氢溶液的浓度,所以我们可以得出反应速率还与反应物的浓度有关。要得出化学反应速率与温度的关系,只需找到温度不同而其他条件完全相同的两个实验作对比,观察表格,容易发现实验③和④对比符合温度越高,化学反应速率越快。

 阅读快车系列答案
阅读快车系列答案