题目内容
“黄铜”是铜锌合金,具有较好机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0 g某种黄铜投入100 g某稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为119.8 g.请计算:
(1)产生氢气的质量为____g.
(2)这种黄铜中铜的质量分数是多少?
(3)剩余溶液中溶质的质量分数是多少?(结果精确到0.1%)
【答案】
(1)0.2 ……………………………………………………………………………1分
(2)设参加反应的锌的质量为x,生成的硫酸锌的质量为y。
Zn+H2SO4====ZnSO4+H2 ↑ ………………………………………………1分
65 161 2
x y 0.2g
65∶2=x∶0.2 g 解得:x=6.5 g ……………………………………………1分
161∶2=y∶0.2 g 解得:y=16.1g ……………………………………………1分

黄铜中铜的质量分数为: ………………………1分
(3)剩余溶液中的ZnSO4质量分数:
 ………………………………………1分
………………………………………1分
答:黄铜中铜的质量分数为67.5%;剩余溶液中硫酸锌的质量分数为15.1%。
【解析】略

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
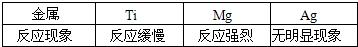
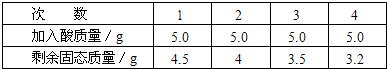
 用化学式表示下列物质
用化学式表示下列物质