题目内容
随着时代的发展,金属材料的应用越来越广泛.
(1)铝比铁的金属活动性更强,但为什么铝制品不易被腐蚀?
(2)请写出工业上以赤铁矿(主要成分是Fe2O2)为原料炼铁的主要化学反应方程式
(3)生产中通常将铬、镍金属融合在铁中制成不锈钢,改变其组成和结构,达到防止铁制品生锈的目的,这一事实说明了一个什么重要的化学道理?
(1)铝比铁的金属活动性更强,但为什么铝制品不易被腐蚀?
(2)请写出工业上以赤铁矿(主要成分是Fe2O2)为原料炼铁的主要化学反应方程式
(3)生产中通常将铬、镍金属融合在铁中制成不锈钢,改变其组成和结构,达到防止铁制品生锈的目的,这一事实说明了一个什么重要的化学道理?
考点:金属的化学性质,铁的冶炼,金属锈蚀的条件及其防护,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:根据铜的性质,铝在空气中表面生成一层致密的氧化铝薄膜和合金的优点进行分析解答本题.
解答:解:(1)铝制品不易被腐蚀的原因:在常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化;
故答案为:在常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化;
(2)工业上以赤铁矿为原料炼铁的化学反应原理:在高温下利用焦炭与氧气生成一氧化碳,氧化铁在高温时能被一氧化碳还原成铁,化学方程式为:3CO+Fe2O3
2Fe+3CO2;
故答案为:3CO+Fe2O3
2Fe+3CO2;
(3)根据生产中通常用铬、镍等金属熔合在铁中制成不锈钢即合金,使熔点降低,便于铸造成型;增加某些特殊性能;合金的硬度大于其组成的金属;即物质的组成结构决定物质的性质,故答案为:物质的组成结构决定物质的性质.
故答案为:在常温下,铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化;
(2)工业上以赤铁矿为原料炼铁的化学反应原理:在高温下利用焦炭与氧气生成一氧化碳,氧化铁在高温时能被一氧化碳还原成铁,化学方程式为:3CO+Fe2O3
| ||
故答案为:3CO+Fe2O3
| ||
(3)根据生产中通常用铬、镍等金属熔合在铁中制成不锈钢即合金,使熔点降低,便于铸造成型;增加某些特殊性能;合金的硬度大于其组成的金属;即物质的组成结构决定物质的性质,故答案为:物质的组成结构决定物质的性质.
点评:本题考查学生根据铜的性质,铝在空气中表面生成一层致密的氧化铝薄膜进行分析解题的能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
下列表示式正确的是( )
| A、三个氧分子O3 |
| B、三个二氧化硫分子3SO2 |
| C、两个氯分子2Cl |
| D、氯化钠的化学式ClNa |
大米、花生等粮食在温度为20℃~38℃、相对湿度达到80%~85%以上时最容易发事变,产生一种叫做黄曲霉素(化学式为C17H12O6)的真菌霉素.黄曲霉素在280℃以上才被破坏.人类的特殊基因在黄曲霉素作用下会发生突变,继而转变为肝癌.下列有关说法错误的是 (相对原子质量:C-12,H-1,O-16)( )
| A、黄曲霉素是一种有机物 |
| B、霉变花生绝对不能食用 |
| C、霉大米可以清洗、蒸煮后食用 |
| D、黄曲霉素分子中碳元素的质量分数小于50% |
下列叙述中,错误的是( )
| A、硬铝可用于制造飞机 |
| B、锌常用于电镀,制造干电池 |
| C、铝可用于制造电线 |
| D、碳素钢的主要成分是碳 |
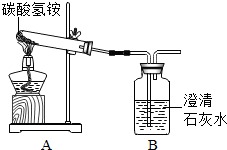 炎炎夏日,查理看到花园植物叶色发黄,于是给植物施用了碳酸氢铵肥料.他将肥料埋入靠近植物根部的土壤时,不小心将部分肥料洒落在干燥地面.可是,很快他发现洒落在地面的肥料消失了.针对洒落地面肥料消失的原因查理开展如下探究活动,请你参与并完成下列问题.【分析猜想】之一:被花园植物吸收了; 之二:被土壤溶液溶解了;
炎炎夏日,查理看到花园植物叶色发黄,于是给植物施用了碳酸氢铵肥料.他将肥料埋入靠近植物根部的土壤时,不小心将部分肥料洒落在干燥地面.可是,很快他发现洒落在地面的肥料消失了.针对洒落地面肥料消失的原因查理开展如下探究活动,请你参与并完成下列问题.【分析猜想】之一:被花园植物吸收了; 之二:被土壤溶液溶解了;