题目内容
(2010?齐齐哈尔一模)(12分)某研究性学习小组同学对Na2CO3溶液与CuSO4溶液反应生成沉淀的成分产生了分歧.【猜想】
小明认为只含CuCO3,小刚认为只含Cu(OH)2,小林认为是CuCO3和Cu(OH)2的混合物,
(1)小明同学的化学反应方程式可表示为______.
(2)小林提出只要在沉淀中加一种试剂即可知道小刚的结论是错误的,该试剂 是______.
【查阅资料】
资 料:Na2CO3溶液与CuSO4溶液反应会产生CuCO3,也可能生成Cu(OH)2沉淀.
【设计方案】
为了进一步确证该沉淀的组成,设计了如下的实验方案:
取上述烘干后的沉淀样品10g,进行如下图所示的实验.

【说明】
(1)碱石灰是CaO与NaOH 的固体混合物.
(2)操作步骤:
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量;
④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量F的质量,得前后两次质量差为1.1g.
【问题探究】
(3)写出图中标有序号的仪器的名称:①______②______
(4)B装置的作用是______,
G装置的作用是______.
(5)反应结束后,打开弹簧夹C,再次缓缓通入一段时间空气,目的是______.
(6)若没有E装置,则测得沉淀样品中CuCO3的质量会______.(填“偏大”或“偏小”)
【数据计算】
(7)CuCO3的质量分数?(在下面空白处写出计算的过程)(3分)
(8)通过上述计算,确认沉淀样品组成是______.
【答案】分析:鉴别碳酸铜与硫酸铜,实质上就是碳酸盐的检验;
氢氧化钠溶液属于碱性物质,能吸收空气中的二氧化碳;
碱石灰的主要成分是生石灰与氢氧化钠的混合物,这两种物质既可以吸收水,还能吸收二氧化碳.
解答:解:(1)小明认为只含CuCO3,则是认为是碳酸钠在与硫酸铜反应,故答案为:Na2CO3+CuSO4═CuCO3↓+Na2SO4;
(2)CuCO3与Cu(OH)2的差别在与碳酸铜能与酸反应产生气体,而氢氧化铜与酸反应无气体放出,所以要鉴别这两种物质,就可以采用加酸的方法,故本题答案为:稀盐酸;
(3)根据已有知识,图中给出的仪器分别为分液漏斗和锥形瓶,所以本题答案为:分液漏斗,锥形瓶;
(4)要确定样品的组成,本题是通过与硫酸反应,准确测定二氧化碳的质量,再计算碳酸铜的质量,从而确定是否含有氢氧化铜,所以需排除空气中二氧化碳和水的干扰,故本题答案为:除空气的二氧化碳,防止空气中的二氧化碳和水进入F装置中,影响测量结果;
(5)为确保实验结果的准确性,需要称量生成的全部二氧化碳的质量,所以要利用压强的关系,把生成的二氧化碳全部赶入F中,故本题答案为:将装置中的二氧化碳全部赶入F中;
(6)浓硫酸具有吸水性,可以把混在二氧化碳中的水蒸气吸掉,如果没有E装置,将会使一部分水蒸气进入F中,从而使二氧化碳质量增大,计算出的碳酸铜的质量偏大,故本题答案为:偏大;
(7)解:分析实验数据可知,生成的二氧化碳的质量为1.1g,设碳酸铜的质量为x,
CuCO3 +H2SO4=CuSO4+H2O+CO2↑
124 44
X 1.1g
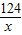 =
=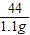
x=3.1g
∴CuCO3%=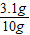 ×100%
×100%
=31%
(8)样品一共10g,通过计算碳酸铜含有3.1g,所以样品中含有氢氧化铜,故答案为:CuCO3和Cu(OH)2.
点评:本题属于难度较大综合性较强的物质推断题,完成此类题目,要注意分析题干所提供的信息,明确各种物质的性质,以及哪些因素对实验结果有影响,认真分析实验数据,仔细作答,还要注意平时知识的积累.
氢氧化钠溶液属于碱性物质,能吸收空气中的二氧化碳;
碱石灰的主要成分是生石灰与氢氧化钠的混合物,这两种物质既可以吸收水,还能吸收二氧化碳.
解答:解:(1)小明认为只含CuCO3,则是认为是碳酸钠在与硫酸铜反应,故答案为:Na2CO3+CuSO4═CuCO3↓+Na2SO4;
(2)CuCO3与Cu(OH)2的差别在与碳酸铜能与酸反应产生气体,而氢氧化铜与酸反应无气体放出,所以要鉴别这两种物质,就可以采用加酸的方法,故本题答案为:稀盐酸;
(3)根据已有知识,图中给出的仪器分别为分液漏斗和锥形瓶,所以本题答案为:分液漏斗,锥形瓶;
(4)要确定样品的组成,本题是通过与硫酸反应,准确测定二氧化碳的质量,再计算碳酸铜的质量,从而确定是否含有氢氧化铜,所以需排除空气中二氧化碳和水的干扰,故本题答案为:除空气的二氧化碳,防止空气中的二氧化碳和水进入F装置中,影响测量结果;
(5)为确保实验结果的准确性,需要称量生成的全部二氧化碳的质量,所以要利用压强的关系,把生成的二氧化碳全部赶入F中,故本题答案为:将装置中的二氧化碳全部赶入F中;
(6)浓硫酸具有吸水性,可以把混在二氧化碳中的水蒸气吸掉,如果没有E装置,将会使一部分水蒸气进入F中,从而使二氧化碳质量增大,计算出的碳酸铜的质量偏大,故本题答案为:偏大;
(7)解:分析实验数据可知,生成的二氧化碳的质量为1.1g,设碳酸铜的质量为x,
CuCO3 +H2SO4=CuSO4+H2O+CO2↑
124 44
X 1.1g
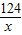 =
=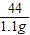
x=3.1g
∴CuCO3%=
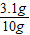 ×100%
×100%=31%
(8)样品一共10g,通过计算碳酸铜含有3.1g,所以样品中含有氢氧化铜,故答案为:CuCO3和Cu(OH)2.
点评:本题属于难度较大综合性较强的物质推断题,完成此类题目,要注意分析题干所提供的信息,明确各种物质的性质,以及哪些因素对实验结果有影响,认真分析实验数据,仔细作答,还要注意平时知识的积累.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目


