题目内容
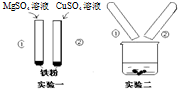 某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:(1)发生反应的化学方程式
(2)实验二:将实验一后两试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤.滤渣中一定含有
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加③ |
没有气泡产生 | ④ |
考点:金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)根据金属的活动性顺序判断反应的发生,并书写反应的方程式、描述实验的现象;
(2)根据现象发现烧杯内的红色固体明显增多说明铁在置换铜,检验是否存在铁,可以利用铁与盐酸反应能产生氢气,滤液中离子的判断要看铁与硫酸铜反应,与硫酸镁不反应考虑.
(2)根据现象发现烧杯内的红色固体明显增多说明铁在置换铜,检验是否存在铁,可以利用铁与盐酸反应能产生氢气,滤液中离子的判断要看铁与硫酸铜反应,与硫酸镁不反应考虑.
解答:解:(1)铁排在铜的前面,因此铁能与硫酸铜反应生成硫酸亚铁和铜,反应的方程式为:Fe+CuSO4=FeSO4+Cu;反应的现象为:Fe丝表面有红色物质析出;铁排在镁的后面,因此铁不能与硫酸镁反应;
(2)将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明铁在置换铜,一段时间后过滤,因此滤渣中一定含有的物质是铜,可能有的物质就是铁,铁可能反应完了,也可能没反应完有剩余;由于铁能与盐酸反应生成氢气,所以取少量滤渣于试管中,向其中滴加稀盐酸,有气泡说明含有铁,否则没有铁;由于铁与硫酸镁不反应,所以滤液中一定含有镁离子,又因为通过检验发现铁没有剩余,说明铁参加了反应到了溶液中以亚铁离子的形式存在,铜离子有没有不能确定,可能有可能没有;
故答案为:(1)Fe+CuSO4=FeSO4+Cu; Fe丝表面有红色物质析出;(2)Cu; Fe; 稀盐酸;Mg2+、Fe2+或Mg2+、Fe2+、Cu2+.
(2)将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明铁在置换铜,一段时间后过滤,因此滤渣中一定含有的物质是铜,可能有的物质就是铁,铁可能反应完了,也可能没反应完有剩余;由于铁能与盐酸反应生成氢气,所以取少量滤渣于试管中,向其中滴加稀盐酸,有气泡说明含有铁,否则没有铁;由于铁与硫酸镁不反应,所以滤液中一定含有镁离子,又因为通过检验发现铁没有剩余,说明铁参加了反应到了溶液中以亚铁离子的形式存在,铜离子有没有不能确定,可能有可能没有;
故答案为:(1)Fe+CuSO4=FeSO4+Cu; Fe丝表面有红色物质析出;(2)Cu; Fe; 稀盐酸;Mg2+、Fe2+或Mg2+、Fe2+、Cu2+.
点评:本题考查了金属活动性顺序的运用,此题容易出错的地方是对滤液中离子的判断:由于铁与硫酸镁不反应,所以滤液中一定含有镁离子,又因为通过检验发现铁没有剩余,说明铁参加了反应,铁与硫酸铜反应生成铜和硫酸亚铁,所以存在亚铁离子,镁离子和亚铁离子是一定存在的,铜离子不能判断.

练习册系列答案
相关题目
下列有关燃烧与灭火的说法中不正确的是( )
| A、用灯帽盖灭酒精灯---隔绝氧气 |
| B、森林灭火时,建立隔离带---撤离可燃物 |
| C、木柴架空了能够燃烧更旺---与氧气充分接触 |
| D、水能灭火---水蒸发吸热能降低可燃物的着火点 |
下列实验操作中错误的是( )
A、 闻气体气温 |
B、 稀释浓硫酸 |
C、 滴管用后不洗涤直接插回原滴管 |
D、 洗涤试管 |
下列做法与社会可持续发展理念相违背的是( )
| A、将工业废水注入地下,治理水污染 |
| B、回收利用易拉罐等废弃金属材料,节约资源 |
| C、开发新能源,减少对煤、石油等化石燃料的依赖 |
| D、倡导步行、公交等出行方式,减少温室气体排放 |