题目内容
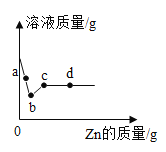
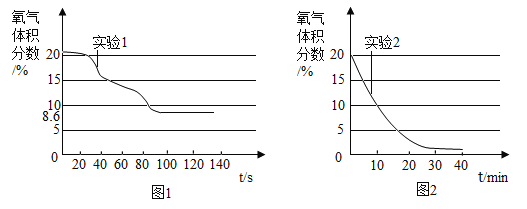
【题目】下图所示的四个图像,能正确反映对应变化关系的是
A.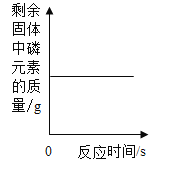 在密闭容器中燃烧一定量的红磷
在密闭容器中燃烧一定量的红磷
B.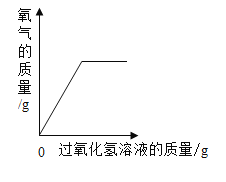 向盛有二氧化锰的烧杯中加入过氧化氢溶液
向盛有二氧化锰的烧杯中加入过氧化氢溶液
C.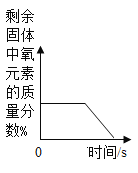 加热一定量的氯酸钾和二氧化锰的混合物制取氧气
加热一定量的氯酸钾和二氧化锰的混合物制取氧气
D.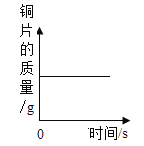 铜片在空气中加热
铜片在空气中加热
【答案】A
【解析】
A、在密闭容器中燃烧一定量的红磷时,红磷燃烧生成五氧化二磷,根据质量守恒定律,固体中磷元素质量不变,该选项对应关系正确;
B、向盛有一定量MnO2的烧杯中加入的H2O2溶液会生成氧气,由于二氧化锰作为催化剂,所以随着H2O2溶液的加入氧气的质量不断增加,该选项对应关系错误;
C、氯酸钾在加热二氧化锰催化作用下生成氯化钾和氧气,二氧化锰的质量不变,剩余固体中氧元素的质量分数会逐渐减小,但最后不为0,该选项对应关系错误;
D、铜片在空气中加热生成氧化铜,所以铜片的质量会不断增大,当反应完毕后铜片的质量不变,该选项对应关系错误。
故选A。

 阅读快车系列答案
阅读快车系列答案【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应:
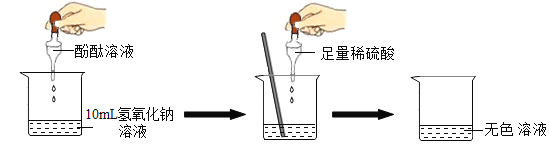
当滴入几滴酚酞溶液后,溶液由无色变为_________色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量:根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊溶液设计实验方案,请你判断并(提示:Ba2+与SO42-可形成BaSO4白色沉淀)
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 有白色沉淀生成 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | _________ | 稀硫酸过量 |
①上述设计的实验方案中,正确的方案是:__________。
②若请你再设计一个确定稀硫酸是否过量的实验方案,你会选用的药品是_______,实验现象及结论是_____________。
(3)成成同学认为稀硫酸和氢氧化钠溶液的反应没有明显现象,他提出可以对某些有明显现象产生的中和反应进行探究,如稀盐酸和氢氧化铝的反应,可观察到的现象为_________,说明中和反应已经发生,反应的化学方程式为_______________。。(提示:氢氧化铝是不溶于水的白色固体,化学式为Al(OH)3)。
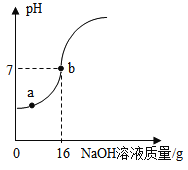
(4)现取10g一定溶质质量分数的稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。计算恰好完全反应时所得溶液的溶质质量分数______。(结果精确到0.1%)
【题目】在化学课上,某活动小组将燃烧的钙迅速伸入到盛满CO2的集气瓶中,钙在其中继续燃烧,反应后冷却,瓶底附着一种白色物质。
(提出问题)小组同学一致认为黑色颗粒是单质碳。那么白色物质是什么呢?
(进行猜想)甲同学认为白色物质是氢氧化钙;乙同学认为白色物质可能是CaO;丙同学认为白色物质是CaCO3;丁同学认为白色物质是______________。其他同学立刻认为甲同学的猜想是错误的,理由是_____________。
(实验探究)
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | ①取适量白色物质于试管中,加入适量水,振荡,用手触摸试管外壁。 | __________ | 白色物质中含有CaO。丙同学的猜想不正确 |
②静置后,向上层清液中通入二氧化碳。 | _________ | ||
方案2 | 取样品少量于试管中,加入足量稀盐酸,观察现象。 | 没有气泡产生 |
(实验总结)钙在二氧化碳中燃烧的化学方程式为________________。