题目内容
CuO和Cu2O都能被氢气还原,产物为铜和水.现有一份CuO和Cu2O的混合物,用氢气还原法测定其中CuO的质量x.实验中可以测定以下数据:W-混合物的质量,W(Cu)-铜的质量,V(H2)-H2的体积(已知密度为ρ),W(H2O)-H2O的质量.现欲通过测定最少的数据计算出x,下列推断正确的是( )
分析:本题涉及的是两个反应CuO+H2
Cu+H2O,Cu2O+H2
2Cu+H2O.如果只有一个数据,显然无法计算.如果有两个,例如W和W(Cu),根据反应前后化合物和单质中的Cu的物质的量不变,可解得x.因此上述四个量中,至少需要测定两个.四个数据的两两组合,从数学上推算,可以有六种组合.但其中W(H2O)-V(H2)这两个量并不是独立变化,所以这些数据的组合共有五种.
| ||
| ||
解答:解:A、此题涉及到两个化学反应,若用氢气还原法测定其中CuO的质量x,至少要测定两个数据才能计算,例如W和W(Cu),根据反应前后化合物和单质中的Cu的物质的量不变,可解得x,故此项正确;
B、从化学方程式可看出,W(H2)和W(H2O)的质量之比是一定的,故利用这两个数据不能计算氧化铜的质量,此项错误;
C、上述四个量中,至少需要测定两个.四个数据的两两组合,从数学上推算,可以有六种组合.但其中W(H2O)-V(H2)这两个量并不是独立变化,所以这些数据的组合共有五种,此项正确.
D、此项说法错误.
故选AC
B、从化学方程式可看出,W(H2)和W(H2O)的质量之比是一定的,故利用这两个数据不能计算氧化铜的质量,此项错误;
C、上述四个量中,至少需要测定两个.四个数据的两两组合,从数学上推算,可以有六种组合.但其中W(H2O)-V(H2)这两个量并不是独立变化,所以这些数据的组合共有五种,此项正确.
D、此项说法错误.
故选AC
点评:本题考查混合物的计算,题目难度角度,为开放性题目,做题中注意根据反应前后质量的变化,用守恒的方法列方程组计算.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
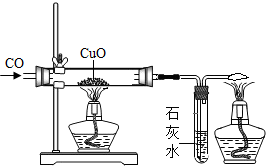 某化学研究性学习小组的同学做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
某化学研究性学习小组的同学做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:【研究课题】探究红色粉末的主要成分
【查阅资料】
(1)有关物质的颜色:
Cu粉末:红色;CuO粉末:黑色;
Cu2O粉末:红色.
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:CuO十H2SO4=CuSO4+H2O;Cu2O+H2SO4=CuSO4+Cu+H2O
【猜想与实验】
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
A.反应前CuO粉末的质量,B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量,D.反应后固体混合物的总质量.
同学们学习了《金属与矿物》一章后,对金属的有关性质产生了浓厚的兴趣.
探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
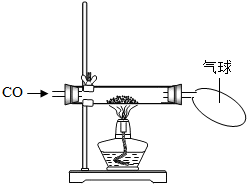
[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
(2)如果硬质玻璃管内红色粉末为两种物质的混合物,要确定粉末中两种物质的质量分数,还需要通过有关数据计算进行判断.下列数据为计算依据的是( )
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a b(填“<,>,或=”)
②产生氢气的速率:a b(填“<,>,或=”)
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算: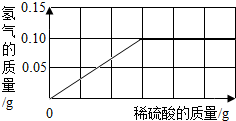
①样品中铜的质量分数为: .
②恰好完全反应时所消耗稀硫酸的质量为 克.
探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:

[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a
②产生氢气的速率:a
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:

①样品中铜的质量分数为:
②恰好完全反应时所消耗稀硫酸的质量为
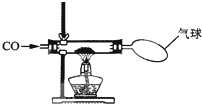 某校化学研究性学习小组的同学在学习了“CO的性质”后,做了如图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
某校化学研究性学习小组的同学在学习了“CO的性质”后,做了如图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务: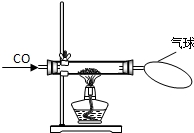 某校化学研究性学习小组的同学在学习了金属与酸的相关知识后,做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
某校化学研究性学习小组的同学在学习了金属与酸的相关知识后,做了如右图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务: