题目内容
【题目】金属在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)用铜制作导线是利用铜的__________性。铁与硫酸铜溶液反应的化学方程式是_____________。
(2)铸造硬币用到Fe、Cu、Ni(镍)等金属,已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=Ni+FeCl2 则Fe、Cu、Ni三种金属活动性由强到弱的顺序为__________(用元素符号表示)。
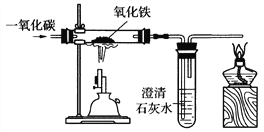
(3)炼铁的原理是利用一氧化碳与氧化铁反应,某同学设计的实验装置如下图:
①实验中玻璃管里的现象是_________,观察到试管里出现的现象是___________。
②该实验要先通CO后加热,目的是___________________。
(4)小强用一定量AgNO3和Cu(NO3)2的混合溶液进行如图实验,并对溶液A和固体B的成分进行分析和研究。
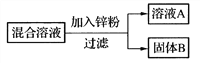
①溶液A中的溶质一定含有______________,可能含有_______________。
②通过以下实验可确定固体B的成分,请将下表填写完整。
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加_________ | 有气泡产生 | 固体B中含有Cu 、Ag和_____ |
【答案】 导电 Fe + CuSO4=Cu + FeSO4 Fe>Ni>Cu 红色粉末变成黑色 有气泡产生、澄清石灰水变浑浊 排出装置中的空气,防止加热时爆炸 Zn(NO3)2 AgNO3和Cu( NO3 )2 稀盐酸 Zn
【解析】(1)用铜制作导线是利用铜的导电性。铁与硫酸铜溶液反应的化学方程式为:Fe + CuSO4=Cu + FeSO4 (2)金属活动性顺序中排在H前的金属可与稀盐酸、稀硫酸反应生成氢气,排在前面的金属可把排在后面的金属从其化合物的溶液中置换出来。Ni+H2SO4=NiSO4+H2↑ ,说明Ni>H ,Fe+NiCl2=Ni+FeCl2,说明Fe>Ni,而Cu不与稀硫酸反应,说明H>Cu,故Fe、Cu、Ni三种金属活动性由强到弱的顺序为Fe>Ni>Cu。(3)①氧化铁是黑色固体,生成的铁因含有杂质而呈黑色,故实验中玻璃管里的现象是红色粉末变成黑色,反应生成的二氧化碳能使澄清石灰水变浑浊。②可燃性气体与空气混合有一个爆炸极限,在爆炸极限范围之内,遇到明火会发生爆炸,一氧化碳具有可燃性,故实验时,先通入一氧化碳,排出装置中的空气,防止加热时爆炸。(4)①排在前面的金属可把排在后面的金属从其化合物的溶液中置换出来,金属活动性之间差距越大反应越容易进行,故向混合溶液中加入锌粉,首先发生反应Zn+2AgNO3=Zn(NO3)2+2Ag,待AgNO3溶液完全反应后,Zn才与Cu(NO3)2溶液反应。不知道Zn的质量,所以不能确定溶液中是否有Cu(NO3)2,故溶液A中的溶质一定含有Zn(NO3)2 ,可能含有AgNO3和Cu( NO3 )2 ②金属活动性顺序中排在H前的金属可与酸反应生成氢气,故可向固体B中滴加稀盐酸或稀硫酸,有气泡产生,说明固体中有能与酸反应的Zn。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案【题目】下列物质的用途与性质对应关系错误的是
选项 | A | B | C | D |
用途 | 金刚石做玻璃刀 | 石墨做电池电极 | 蜡烛在空气中燃烧 | N2用作保护气 |
性质 | 金刚石硬度大 | 石墨具有导电性 | 氧气具有可燃性 | N2化学性质不活泼 |
A.AB.BC.CD.D

