题目内容
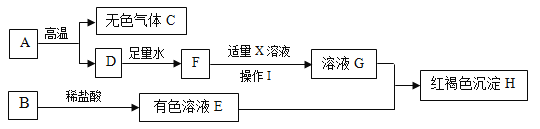
【题目】氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl 的制备流程如下:
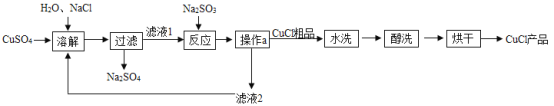
(1)“滤液 1”中除了Na+、SO42-外,还存在较多的离子是_____、_____(写离子符号)。
(2)“反应”中发生的化学变化是 2CuCl2+Na2SO3=2CuCl![]() +2NaCl+SO3
+2NaCl+SO3![]() ,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_____, 反应的基本类型为_____。
,产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为_____, 反应的基本类型为_____。
(3)“操作 a”的名称是_____。本流程中可以循环利用的物质(水除外)是_____(写化学式)。
(4)可用“水洗”的原因是_________,“醇洗”的目的是_____。
(5)160g CuSO4与足量NaCl 经上述制备流程,可生成的 CuCl 最多是_____g。
【答案】Cl- Cu2+ SO3+H2O=H2SO4 化合反应 过滤 NaCl CuCl难溶于水,用水洗去可溶性杂质,保留CuCl 快速去除CuCl表面的水、防止其变质 99.5
【解析】
(1)从“溶解”步骤可知,放入的药品有氯化钠和硫酸铜,故“滤液 1”中除了Na+、SO42-外,还存在较多的Cu2+、Cl-。
(2)部分非金属氧化物能与水反应生成酸,产生的SO3迅速与水化合生成硫酸,反应的化学方程式为SO3+H2O=H2SO4, 该反应是两种物质生成一种物质的反应,属于化合反应。
(3)通过“操作 a”可以得到滤液2和氯化亚铜固体相品,故“操作 a”是过滤。根据该反应方程式可知,通过“操作 a”后可以得到氯化钠溶液,而在“溶解”步骤中需要氯化钠,故本流程中可以循环利用的物质是NaCl。
(4)已知CuCl难溶于水和乙醇,在潮湿空气中易变质。所以用“水洗”是因为CuCl难溶于水,用水洗去可溶性杂质,保留CuCl;“醇洗”目的是快速去除CuCl表面的水、防止其变质。
(5)分析上述制备流程,在整个过程中铜元素的质量没有改变,故反应物硫酸铜中含铜元素的质量与生成物氯化亚铜的质量是相等的,设生成 CuCl 的质量最多为x。
![]() ,解得x=99.5g。
,解得x=99.5g。

 应用题天天练四川大学出版社系列答案
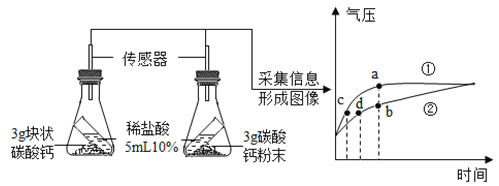
应用题天天练四川大学出版社系列答案【题目】某化学兴趣小组的同学在做“二氧化碳的实验室制取及性质”实验时,发现长时间向澄清石灰水中通入二氧化碳,石灰水先变浑浊,后又变澄清,加热澄清的液体又变浑浊。请教老师后知道:难溶的碳酸钙能与二氧化碳和水反应,生成易溶解的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。碳酸氢钙受热易分解:Ca(HCO3)2 ![]() CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
CaCO3↓+H2O+CO2↑。他们对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)
一定量CO2与NaOH溶液反应后的溶液中溶质组成是什么?
(查阅资料)
(1)通入少量CO2,反应的化学方程式为: __________________;
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3;
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(提出猜想)
(1)溶质为Na2CO3;
(2)溶质为NaHCO3;
(3)溶质为NaOH和Na2CO3;
(4)溶质为___________(填化学式)。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
A. 取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液 | 有____生成 | 猜想(2)不成立 |
B. 取步骤a中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(3)不成立 |
(得出结论)
猜想(4)成立。
(讨论交流)
试写出NaHCO3受热分解的化学方程式: ___________。