��Ŀ����
����Ŀ����5�֣�ijʵ��С����һ������ʯ��ˮ��ͨ��CO2 ������������������ͨ��CO2 �����Ĺ�ϵ����ͼ��ʾ����֪��Ӧ��CaCO3+H2O+CO2=Ca(HCO3)2 ��Ca(HCO3)2 ������ˮ��
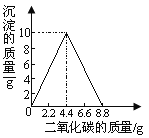
��1��������ʵ������������۲쵽��������������2�֣���Ϊʹ��Һ������������ʵ�������Ϊ���ֵ������������Ӧͨ��CO2 ������������
��������CO2 ������ˮ�е��ܽ⣩
��2�������ͨCO2����ǰʯ��ˮ�����ʵ�����������д�����������2����
���𰸡����Ȼ��ǣ������ 8.8g (2) 7.4g
��������
���������(1) һ������ʯ��ˮ��ͨ��CO2 ��������Ӧ��CO2 +Ca(OH)2 ==CaCO3��+ H20������ͨ��CO2 ���ַ�����Ӧ����CaCO3+H2O+CO2=Ca(HCO3)2 ����ʵ������������۲쵽���������Ȼ��ǣ��������ͨ���۲�ͼ�е����ݣ�Ϊʹ��Һ������������ʵ�������Ϊ���ֵ������������Ӧͨ��CO2 ������8.8g
(2)����ͼ�е����ݣ���֪��ͨ���CO2 ������4.4gʱ��ǡ����ʯ��ˮ������Ca(OH)2��ȫ��Ӧ�������ݷ�Ӧ��CO2 +Ca(OH)2 ==CaCO3��+ H20��CO2��Ca(OH)2��������ϵ���������ʯ��ˮ�����ʵ�����
���⣺�����ʯ��ˮ������Ca(OH)2������Ϊx
CO2+ Ca(OH) 2 ==== CaCO3��+ H2O
44 74
4.4g x
44/74=4.4g/x x=7.4g
������ʯ��ˮ������Ca(OH)2������Ϊ7.4g

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�