题目内容
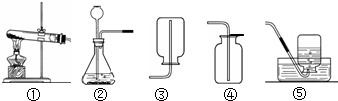
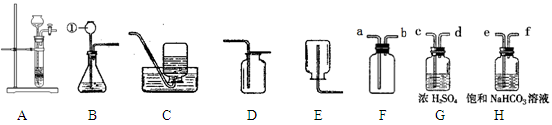
下图是实验室常用来制取气体的装置,根据所学的知识回答以下问题: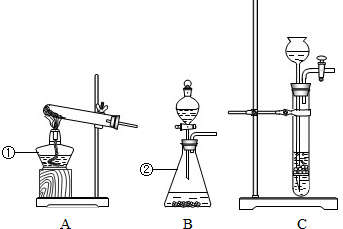
(1)标号仪器的名称:①
(2)实验室用过氧化氢溶液制取氧气,选用的最佳装置是
(3)某同学为了探究H2O2溶液的质量分数对反应速率有没有影响做了一组实验:每次均取5ml30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验.记录数据如下:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2粉末用量(克) | m | m | m | m | 0.6 | 0.6 | 0.6 | 0.6 |
| 收集到500ml气体所需时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后液体温度(℃) | 24 | 34 | 39 | 56 | 65 | 67 | 69 | 70 |
②由表中数据观察:H2O2溶液的质量分数对反应速率有没有影响呢?如果有,是怎样影响呢?
(4)13.6g溶质质量分数为10%的过氧化氢溶液中含有H2O2的质量是
分析:(1)熟悉常见仪器,了解它们的名称;
(2)用过氧化氢溶液制取氧气,要用二氧化锰做催化剂,是固体和液体在常温下的反应,据此选择实验装置;还可用加热高锰酸钾的方法制取氧气;
(3)①实验的目的可以从题意“某同学为了探究H2O2溶液的质量分数对反应速率有没有影响做了一组实验”中提取;m的质量也可根据题意了解;②根据表格中“收集到500ml气体所需时间”可知是否受影响;从“反应后液体温度”可知是放热反应;
(4)先计算出过氧化氢溶液中含有H2O2的质量,再根据过氧化氢制取氧气的反应式计算可得氧气的质量.
(2)用过氧化氢溶液制取氧气,要用二氧化锰做催化剂,是固体和液体在常温下的反应,据此选择实验装置;还可用加热高锰酸钾的方法制取氧气;
(3)①实验的目的可以从题意“某同学为了探究H2O2溶液的质量分数对反应速率有没有影响做了一组实验”中提取;m的质量也可根据题意了解;②根据表格中“收集到500ml气体所需时间”可知是否受影响;从“反应后液体温度”可知是放热反应;
(4)先计算出过氧化氢溶液中含有H2O2的质量,再根据过氧化氢制取氧气的反应式计算可得氧气的质量.
解答:解:(1)熟悉常见仪器,了解它们的名称.图中①酒精灯②锥形瓶;故答案为:酒精灯、锥形瓶;
(2)用过氧化氢溶液制取氧气,要用二氧化锰做催化剂,是固体和液体在常温下的反应,装置B适合固体和液体在常温下的反应,所以我们可选B;还可选用A作为加热高锰酸钾制取氧气的发生装置,反应方程式是:2KMnO4
K2MnO4+MnO2+O2↑;故答案为:B、2KMnO4
K2MnO4+MnO2+O2↑;
(3)①据题意可知实验目的:探究H2O2溶液的质量分数对反应速率的影响;因为是探究H2O2溶液的质量分数对反应速率的影响,所以其他量都不变,从表格中的数字可知m的数值是:0.6.故答案为:探究H2O2溶液的质量分数对反应速率的影响、0.6;
②从表格中“收集到500ml气体所需时间”可知,H2O2溶液的质量分数越大,收集500ml所需时间越短.就是说有H2O2溶液的质量分数越大反应速率越快;从“反应后液体温度”可知H2O2溶液的质量分数越大,放出的热量越多,是放热反应.故答案为:影响:H2O2溶液的质量分数越大反应速率越快、放热;
(4)13.6g溶质质量分数为10%的过氧化氢溶液中含有H2O2的质量是:13.6×10%=1.36g
设可生成xg氧气
2H2O2
2H2O+O2↑
68 32
1.36 x
=
x=0.64g
答:13.6g溶质质量分数为10%的过氧化氢溶液中含有H2O2的质量是 1.36g;可得氧气的质量是 0.64g.
(2)用过氧化氢溶液制取氧气,要用二氧化锰做催化剂,是固体和液体在常温下的反应,装置B适合固体和液体在常温下的反应,所以我们可选B;还可选用A作为加热高锰酸钾制取氧气的发生装置,反应方程式是:2KMnO4
| ||
| ||
(3)①据题意可知实验目的:探究H2O2溶液的质量分数对反应速率的影响;因为是探究H2O2溶液的质量分数对反应速率的影响,所以其他量都不变,从表格中的数字可知m的数值是:0.6.故答案为:探究H2O2溶液的质量分数对反应速率的影响、0.6;
②从表格中“收集到500ml气体所需时间”可知,H2O2溶液的质量分数越大,收集500ml所需时间越短.就是说有H2O2溶液的质量分数越大反应速率越快;从“反应后液体温度”可知H2O2溶液的质量分数越大,放出的热量越多,是放热反应.故答案为:影响:H2O2溶液的质量分数越大反应速率越快、放热;
(4)13.6g溶质质量分数为10%的过氧化氢溶液中含有H2O2的质量是:13.6×10%=1.36g
设可生成xg氧气
2H2O2
| ||
68 32
1.36 x
| 68 |
| 1.36 |
| 32 |
| x |
x=0.64g
答:13.6g溶质质量分数为10%的过氧化氢溶液中含有H2O2的质量是 1.36g;可得氧气的质量是 0.64g.
点评:本题主要考查化学反应式的书写和实验探究,以及相关的计算,要求同学们能够掌握较为综合的化学问题.

练习册系列答案
相关题目