题目内容
【题目】随着生产的发展,家庭日用品的种类也日益增多,下图是几种常见的家用清洁剂。

(1)“漂白水”能快速漂除衣物污渍,其有效成分为次氯酸钠(NaClO),次氯酸钠中含有的非金属元素是_______(写元素名称)。
(2)“洁厕灵”的有效成分是稀盐酸,若与“漂白水”混用,易产生一种有毒气体。化学方程式为NaClO+2HCl=NaCl+X↑+H2O,则X的化学式为_______。
(3)“管道通”可使堵塞的管道畅通无阻,其管道疏通剂的有效成分为氢氧化钠,在使用时禁止与皮肤接触,其原因是___;在使用时也不能与“洁厕灵”混合使用,其原因是____(用化学方程式表示)。
【答案】氯元素和氧元素 Cl2 氢氧化钠有强烈的腐蚀性 NaOH+HCl=NaCl+H2O
【解析】
(1)由次氯酸钠(NaClO)的化学式可知,次氯酸钠(NaClO)中含钠、氯、氧三种元素,非金属元素是氯、氧,故填氯元素和氧氧元素;
(2)根据化学方程式NaClO+2HCl=NaCl+X↑+H2O,可知反应前有1个Na原子、1个氧原子、2个氢原子、3个氯原子,反应后有1个Na原子、1个氧原子、2个氢原子、1个氯原子和1个X,根据质量守恒定律可知1个X中含有2个氯原子,故填Cl2;
(3)氢氧化钠有强烈的腐蚀性,使用时禁止与皮肤接触,如不慎沾到皮肤上应用大量水冲洗,再涂上硼酸溶液,故填氢氧化钠有强烈的腐蚀性;
管道疏通剂的有效成分为氢氧化钠,洁厕灵主要成分是盐酸,如果管道通与洁厕灵混合使用,会使氢氧化钠和盐酸反应生成氯化钠和水,使疏通剂失效,故填NaOH+HCl=NaCl+H2O。

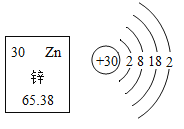
【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
![]()
(提出问题)常温下钠与氧气反应,产物有哪些?
(查阅资料)钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
(作出猜想)常温下钠与氧气反应的产物。
猜想1:Na2O; 猜想2:Na2O2; 猜想3:_______。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | (_____) | 猜想1正确 |
(继续探究)钠在空气中放置一段时间得到白色固体的成分
(作出猜想)猜想一:Na2CO3猜想二:Na2CO3和NaOH
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量_____。 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入酚酞。 | (______) |
(实验反思)
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式_______;
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为______;
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2___碱性氧化物(填“是”或“不是”)。
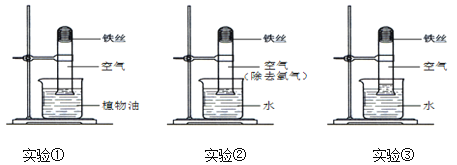
【题目】第三组同学进行“影响可燃物燃烧剧烈程度的因素”的探究
按下表进行燃烧实验,记录反应的现象。
实验编号 | 可燃物 | 集气瓶中气体 | 反应现象 |
① | 细铁丝 | 氧气 | 剧烈燃烧、大量放热________ |
② | 细铁丝 | 空气 | 不燃烧 |
③ | 铁粉 | 空气 | 剧烈燃烧、迸发出大量火星 |
(1)实验①的现象还有__________________;该反应的化学方程式为____________。
(2)欲证明可燃物燃烧剧烈程度与氧气的浓度有关,须进行的对比实验为__________(填序号);通过实验②和③对比,可得出的结论是___________。
(3)相同条件下,氧气浓度还会影响可燃物是否完全燃烧,举例说明_________。