题目内容
16、金属、金属材料的性质在很大程度上决定了它们的用途.下列相关说法中不正确的是( )
分析:可根据的合金的特性来分析.合金具有高强度、硬度,抗腐蚀性的特点.
解答:解:A、钛合金与人体有很好的相容性,且性质稳定,抗腐蚀性强,所以可用来制造人造骨骼.正确.
B、金属具有导热性,可用来制造加热容器,所以B正确.
C、不锈钢是一种特殊的合金,由于其抗腐蚀性好,所以看用来制造医疗器械.
D、由于其熔点低,不适合制造发热体.所以D错误.
故选D
B、金属具有导热性,可用来制造加热容器,所以B正确.
C、不锈钢是一种特殊的合金,由于其抗腐蚀性好,所以看用来制造医疗器械.
D、由于其熔点低,不适合制造发热体.所以D错误.
故选D
点评:本题结合新信息考查合金的性质,属于基础题,只要根据合金的性质判断其用途即可.

练习册系列答案
相关题目
金属、金属材料的性质在很大程度上决定了它们的用途.下列相关说法中不正确的是( )
| A、铁具有良好的导热性,可以用于制造炊具 | B、不锈钢抗腐蚀性好,常用于制造医疗器械 | C、铅锑合金的熔点较低、电阻率较大,常用于制成发热体 | D、铝合金轻而坚韧,可作汽车、飞机和火箭的材料 |
 20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
20、通过“金属和金属材料”和“燃烧”的复习,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题: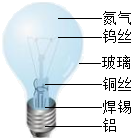 灯泡是家庭经常使用的电光源,其构造如图所示,根据图中标注回答问题:
灯泡是家庭经常使用的电光源,其构造如图所示,根据图中标注回答问题: