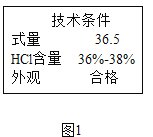
题目内容
【题目】【2016年山东省烟台市】久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],某化学兴趣小组对铜生锈的条件进行了以下探究。
【提出猜想】根据铜锈的组成元素推测,铜生锈可能是铜与空气中的二氧化碳、水等物质反应的结果。
【实验设计】兴趣小组同学取打磨光量的铜丝,设计了如图所示的四个实验。
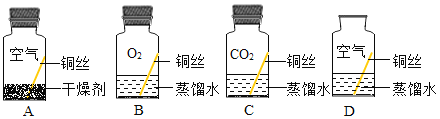
【现象分析】若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现。
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 。
(2)B瓶与D瓶中的现象对比,可以得出的结论是 。
【实验结论】由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果。
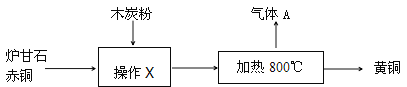
【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜。
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
如图是该兴趣小组设计的两种回收铜的实验方案:
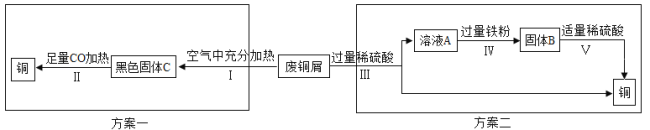
【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是 (填化学式)。
②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是 。
③步骤Ⅴ过程发生反应的化学方程式为 。
④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一 (填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是 (任答一点)。
【答案】(1)除去水中溶解的氧气(2)铜生锈需要二氧化碳 氧气、水和二氧化碳
【分析评价】①CuO ②过滤 ③Fe+H2SO4=FeSO4+H2↑ ④ = 方案二不需加热
【解析】(1)经煮沸后迅速冷却的蒸馏水,其原因是除去水中溶解的氧气;故填:除去水中溶解的氧气;(2)铜生锈是否需要空气中的二氧化碳,变量是否含有二氧化碳,其余条件必须相同,所以B和D形成对照实验,可以探究是否需要有二氧化碳参加反应,故得出结论:铜生锈需要二氧化碳;通过上述四个实验可分析得出,铜生锈是铜与空气中的氧气、水和二氧化碳共同作用的结果,故填:氧气、水和二氧化碳;
【分析评价】①在化学反应CuO+CO![]() Cu+CO2中,氧化铜失去了氧,发生了还原反应,故填:CuO;②步骤Ⅲ、Ⅳ、Ⅴ都需要分离难溶性杂质,过滤是分离难溶性杂质的方法,所以都需要进行的实验操作是过滤,故填:过滤;③因为加入过量铁粉,所以固体B中含有铁和铜,加入稀硫酸,铜不反应,铁和硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑,故填:Fe+H2SO4=FeSO4+H2↑;④根据质量守恒定律,反应前后元素的种类、元素的质量都不变,两种方案中反应前铜元素质量相等,所以反应后生产铜的质量相等;方案二与方案一相比较,方案二不需加热,故填:=;方案二不需加热。
Cu+CO2中,氧化铜失去了氧,发生了还原反应,故填:CuO;②步骤Ⅲ、Ⅳ、Ⅴ都需要分离难溶性杂质,过滤是分离难溶性杂质的方法,所以都需要进行的实验操作是过滤,故填:过滤;③因为加入过量铁粉,所以固体B中含有铁和铜,加入稀硫酸,铜不反应,铁和硫酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+H2SO4=FeSO4+H2↑,故填:Fe+H2SO4=FeSO4+H2↑;④根据质量守恒定律,反应前后元素的种类、元素的质量都不变,两种方案中反应前铜元素质量相等,所以反应后生产铜的质量相等;方案二与方案一相比较,方案二不需加热,故填:=;方案二不需加热。