题目内容
【题目】【2016年上海市】实验室制备二氧化碳的实验如下:
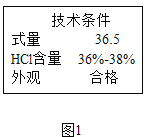
①市售浓盐酸的标签局部见下图,该盐酸中HCl质量分数的范围是 。为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸 。
②用甲装置制备二氧化碳,选择的固体药品是 (选填编号)。
A.粉末状石灰石 B.块状大理石 C.粉末状熟石灰 D.块状生石灰
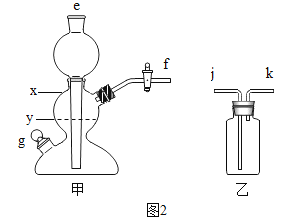
③控制所加盐酸的量,使反应时甲装置内液面位于 处(选填“x”或“y”)为宜。
④收集二氧化碳,应将甲的 处与乙的 处连接(选填有关编号)。
⑤写出用澄清石灰水检验二氧化碳的化学方程式 .
⑥反应生成了0.1mol二氧化碳,求稀盐酸中参与反应的HCl的质量。(根据化学方程式列式计算) 。
【答案】①36%---38% 稀释 ② b ③y ④ f、j ⑤ CO2+Ca(OH)2=CaCO3↓+H2O ⑥7.3 g
【解析】①根据标签可知,该盐酸中HCl质量分数的范围是36%---38%,反应物浓度越大反应速度越快,若用浓盐酸制取二氧化碳,反应速度太快,并且制得的二氧化碳中含有氯化氢气体,故应该将浓盐酸稀释。
②制取二氧化碳用大理石或石灰石与稀盐酸,反应物之间接触面积越大反应速度越快,用粉末状石灰石反应速度太快,不易控制,应该选择块状的固体,故选b
③如果液面不低于y,反应时会有液体进入导气管
④f是导气管,二氧化碳的密度比空气的密度大,进入乙中后空气被赶到上方空间,k有利于空气导出,是出气管,那么j是进气管,故f与j 连接
⑤ 检验二氧化碳用澄清石灰水,CO2+Ca(OH)2=CaCO3↓+H2O
⑥设稀盐酸中参与反应的HCl的质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73g 1mol
x 0.1mol
![]() =
= ![]() 解得x=7.3 g
解得x=7.3 g
答:稀盐酸中参与反应的HCl的质量是7.3 g

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )
物质 | a | b | c | d |
反应前质量/g | 6.4 | 3.2 | 4.0 | 2.6 |
反应后质量/g | 5.2 | x | 7.2 | 2.6 |
A.a和c是反应物 B.d一定是催化剂
C.X=2.0g D.该反应是化合反应
【题目】从分子的角度分析并解释下列事实,不正确的是( )
选项 | 事实 | 解释 |
A | 碘酒是混合物 | 由不同种分子构成 |
B | 端午时节粽飘香 | 分子在不断运动着 |
C[ | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |