题目内容
【题目】电解水的装置如图,回答下列问题:
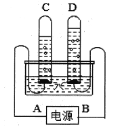
①写出电解水的化学方程式(12) ;
②实验取用180mL水,这些水的物质的量约为(13) ;
③试管C中的气体是(14) ,A 处是电源的(15) 极(填写“正”或“负”);
④为了使电解顺利进行需要向水中加入硫酸,若向100g水中加入l0g 质量分数为0.1的稀硫酸,此时溶液的质量分数为(16) 。
⑤有同学想知道:若向水中加入食盐,是否同样可以实现电解水?他仍用右图装置进行食盐溶液的电解,发现D中也有气体,且有黄绿色,则该气体是(17) (选填编号)。
A.氧气 B.氢气 C.氯化氢 D.氯气
电解结束后向溶液滴入酚酞,溶液变红,说明还有(18) (填写化学式)生成。
【答案】①2H2O![]() 2H2↑+O2↑ ②180g ③氢气,负极 ④0.9% ⑤D ,NaOH
2H2↑+O2↑ ②180g ③氢气,负极 ④0.9% ⑤D ,NaOH
【解析】
试题分析:电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,质量比为8:1 ,该实验能得出水是由氢元素和氧元素组成的结论。实验时要向水中加入少量硫酸或硫酸钠,目的的增强水的导电性。故C中的是氢气,与负极相连,D中的是氧气,与正极相连;向100g水中加入l0g 质量分数为0.1的稀硫酸,那么溶液的质量=100g+10g=110g,稀释过程中溶质的质量不变,那么溶质的质量=10g×10%=1g,溶质的质量分数
=1g/110g ×100%=0.9%;
黄绿色的气体是氯气,电解结束后向溶液滴入酚酞,溶液变红,说明生成的溶液呈碱性,依据质量守恒定律化学反应前后元素的质量不变,那么溶液中有氢氧化钠。

练习册系列答案
相关题目