题目内容
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸质量分数相等)信息:
NaHCO3+HCl═NaCl+H2O+CO2↑;KHCO3+HCl═KCl+H2O+CO2↑
| 50克盐酸 | 50克盐酸 | 50克盐酸 | |
| 混合物质量 | 9.2克 | 15.7克 | 27.6克 |
| CO2质量 | 4.4克 | 6.6克 | 6.6克 |
- A.盐酸的质量分数为7.3%
- B.加入混合物9.2g时盐酸过量
- C.根据表中数据不能计算出混合物中碳酸氢钠的质量分数
- D.混合物中碳酸氢钠和碳酸氢钾的质量比为1:1
B
分析:A、要求盐酸的质量分数,则需选择盐酸全部参加反应的一组;对比表中数据可知:50g盐酸最多生成气体6.6g;依据二氧化碳的质量结合方程式分析解答;
B、根据由于固体混合物从9.2 g→15.7 g,二氧化碳气体的质量还在增加,故加入9.2 g混合物时盐酸过量进行解答;
C、根据由表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,固体混合物的总质量及产生标准状况下的二氧化碳气体的质量可以计算出NaHCO3的质量分数进行解答;
D、根据表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,据此结合二者与盐酸反应方程式分析解答.
解答:A、NaHCO3和KHCO3与盐酸反应的方程式分别为:NaHCO3+HCl═NaCl+CO2↑+H2O,KHCO3+HCl═KCl+CO2↑+H2O,由方程式可知:HCl~CO2,据此关系式进行求解;
设50g某浓度的盐酸中溶质的质量是x
HCl~CO2
36.5 44
x 6.6g
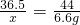
解得x=5.475g
所以所用盐酸的溶质质量分数是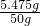 ×100%=10.95%,故A错误;
×100%=10.95%,故A错误;
B、由于固体混合物从9.2 g→15.7 g,二氧化碳气体的质量还在增加,故加入9.2 g混合物时盐酸过量,故B正确;
C、由表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,固体混合物的总质量及产生的二氧化碳气体的质量可以计算出混合物中二者各自的质量,故可以计算NaHCO3的质量分数,故C错误;
D、设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为9.2g-y,设碳酸氢钠对应的二氧化碳的质量为z.
NaHCO3+HCl═NaCl+CO2↑+H2O
84 44
y z
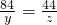 --------------①
--------------①
KHCO3+HCl═KCl+CO2↑+H2O
100 44
9.2g-y 4.4g-z
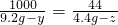 ---------②
---------②
根据①②解得:y=4.2g,即碳酸氢钠的质量为4.2g,碳酸氢钾的质量为5g.两者质量为4.2g:5g=21:25,而不是1:1,故D错误.
故选B.
点评:考查混合物的有关计算,难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.
分析:A、要求盐酸的质量分数,则需选择盐酸全部参加反应的一组;对比表中数据可知:50g盐酸最多生成气体6.6g;依据二氧化碳的质量结合方程式分析解答;
B、根据由于固体混合物从9.2 g→15.7 g,二氧化碳气体的质量还在增加,故加入9.2 g混合物时盐酸过量进行解答;
C、根据由表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,固体混合物的总质量及产生标准状况下的二氧化碳气体的质量可以计算出NaHCO3的质量分数进行解答;
D、根据表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,据此结合二者与盐酸反应方程式分析解答.
解答:A、NaHCO3和KHCO3与盐酸反应的方程式分别为:NaHCO3+HCl═NaCl+CO2↑+H2O,KHCO3+HCl═KCl+CO2↑+H2O,由方程式可知:HCl~CO2,据此关系式进行求解;
设50g某浓度的盐酸中溶质的质量是x
HCl~CO2
36.5 44
x 6.6g
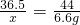
解得x=5.475g
所以所用盐酸的溶质质量分数是
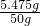 ×100%=10.95%,故A错误;
×100%=10.95%,故A错误;B、由于固体混合物从9.2 g→15.7 g,二氧化碳气体的质量还在增加,故加入9.2 g混合物时盐酸过量,故B正确;
C、由表中数据可知,故加入9.2g混合物时,盐酸有剩余,混合物完全反应,固体混合物的总质量及产生的二氧化碳气体的质量可以计算出混合物中二者各自的质量,故可以计算NaHCO3的质量分数,故C错误;
D、设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为9.2g-y,设碳酸氢钠对应的二氧化碳的质量为z.
NaHCO3+HCl═NaCl+CO2↑+H2O
84 44
y z
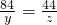 --------------①
--------------①KHCO3+HCl═KCl+CO2↑+H2O
100 44
9.2g-y 4.4g-z
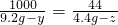 ---------②
---------②根据①②解得:y=4.2g,即碳酸氢钠的质量为4.2g,碳酸氢钾的质量为5g.两者质量为4.2g:5g=21:25,而不是1:1,故D错误.
故选B.
点评:考查混合物的有关计算,难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
| 某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸质量分数相等)信息: NaHCO3+HCl═NaCl+H2O+CO2↑;KHCO3+HCl═KCl+H2O+CO2↑
|
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
则下列分析推理中不正确的是( )
| 50mL | 50mL | 50mL | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、盐酸的物质的量浓度为3.0mol?L |
| B、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| C、加入混合物9.2g时盐酸过量 |
| D、15.7g混合物恰好与盐酸完全反应 |
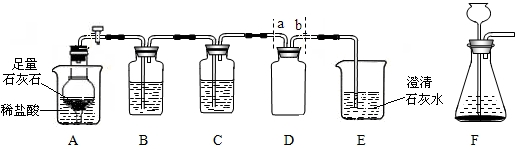
 20、某校在进行“消防演练”时,让学生用干粉灭火器进行灭火训练.化学兴趣小组的同学在老师的指导下,对灭火剂碳酸氢钠(NaHCO3)的灭火原理进行实验探究,请你参与.
20、某校在进行“消防演练”时,让学生用干粉灭火器进行灭火训练.化学兴趣小组的同学在老师的指导下,对灭火剂碳酸氢钠(NaHCO3)的灭火原理进行实验探究,请你参与.