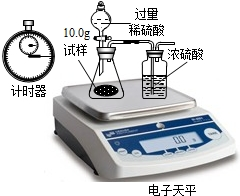
题目内容
20℃的饱和硫酸铜溶液100克等分成两份,将一份升温到30℃,另一份加入无水硫酸铜粉末1克,温度仍保持20℃,则在这两种情况下,均不改变的是
- A.溶剂质量
- B.溶液质量
- C.溶质的溶解度
- D.溶液的浓度
D
分析:升温至30℃的硫酸铜溶液变为不饱和溶液,溶质、溶剂、溶液的质量不变,溶质的质量分数也不变;此题中的无水硫酸铜加入到水中后会吸收溶液中的水是自己形成CuSO4?5H2O,因原溶液饱和故吸收水分后会析出CuSO4?5H2O,但剩余的溶液仍为饱和溶液,生成的CuSO4?5H2O的质量大于1克硫酸铜生成的CuSO4?5H2O的质量,故溶质、溶剂、溶液的质量都减小.
解答:A、加入无水硫酸铜粉末后会吸收溶液中的水是自己形成CuSO4?5H2O,溶剂的质量减小;故错.
B、无水硫酸铜加入到水中后会吸收溶液中的水是自己形成CuSO4?5H2O,因原溶液饱和故吸收水分后会析出CuSO4?5H2O,所以溶液质量减小;故错.
C、20℃硫酸铜的溶解度与30℃的硫酸铜溶解度不同;故错.
D、升温至30℃的硫酸铜溶液变为不饱和溶液,溶质、溶剂、溶液的质量不变,故浓度不变;无水硫酸铜加入到水中后,虽溶质、溶剂、溶液的质量都减小,但仍为20℃的饱和硫酸铜溶液,故浓度不变;故对.
故选D.
点评:此题是结合溶液的一道分析题,是对硫酸铜固体的性质考查又是对溶液性质的考查,属一道学生易错题.
分析:升温至30℃的硫酸铜溶液变为不饱和溶液,溶质、溶剂、溶液的质量不变,溶质的质量分数也不变;此题中的无水硫酸铜加入到水中后会吸收溶液中的水是自己形成CuSO4?5H2O,因原溶液饱和故吸收水分后会析出CuSO4?5H2O,但剩余的溶液仍为饱和溶液,生成的CuSO4?5H2O的质量大于1克硫酸铜生成的CuSO4?5H2O的质量,故溶质、溶剂、溶液的质量都减小.
解答:A、加入无水硫酸铜粉末后会吸收溶液中的水是自己形成CuSO4?5H2O,溶剂的质量减小;故错.
B、无水硫酸铜加入到水中后会吸收溶液中的水是自己形成CuSO4?5H2O,因原溶液饱和故吸收水分后会析出CuSO4?5H2O,所以溶液质量减小;故错.
C、20℃硫酸铜的溶解度与30℃的硫酸铜溶解度不同;故错.
D、升温至30℃的硫酸铜溶液变为不饱和溶液,溶质、溶剂、溶液的质量不变,故浓度不变;无水硫酸铜加入到水中后,虽溶质、溶剂、溶液的质量都减小,但仍为20℃的饱和硫酸铜溶液,故浓度不变;故对.
故选D.
点评:此题是结合溶液的一道分析题,是对硫酸铜固体的性质考查又是对溶液性质的考查,属一道学生易错题.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
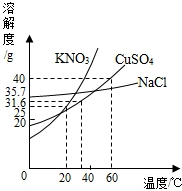 如图是几种盐的溶解度曲线,下列说法正确的是( )
如图是几种盐的溶解度曲线,下列说法正确的是( )| A、40℃时,将35克食盐溶于100克水中,降温至0℃时,可析出氯化钠晶体 | B、20℃时硝酸钾饱和溶液的质量分数是31.6% | C、60℃时,200克水中,溶解80克硫酸铜达到饱和,当温度降至30℃时,可析出30克硫酸铜晶体 | D、30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是NaCl |
下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是( )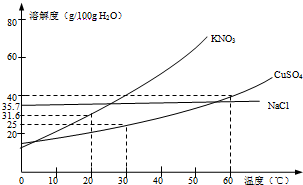

| A、20℃时,硝酸钾饱和溶液的质量分数是31.6% | B、30℃时,将35g硝酸钾和35g食盐同时溶于100g水中,蒸发时先析出的是氯化钠 | C、40℃时,35g食盐溶于100g水中,降温至0℃时,可析出氯化钠晶体 | D、60℃时,200g水中溶解80g硫酸铜达饱和,降温至30℃,可析出30g硫酸铜晶体 |
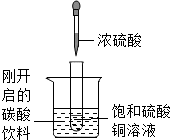 如图所示,把试管小心放入盛有(20℃)碳酸饮料的烧杯中,试管中先放入适量饱和硫酸铜溶液,再用滴管滴加5ml浓硫酸于试管中,试回答下列问题:
如图所示,把试管小心放入盛有(20℃)碳酸饮料的烧杯中,试管中先放入适量饱和硫酸铜溶液,再用滴管滴加5ml浓硫酸于试管中,试回答下列问题: