题目内容
【题目】工业上从铝土矿(主要成分为![]() ,还含有一些不溶性杂质)中生产
,还含有一些不溶性杂质)中生产![]() 的流程如下:
的流程如下:
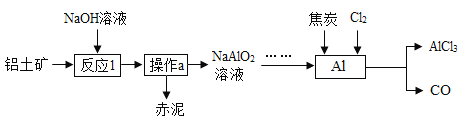
(1)反应前,会将铝土矿的矿石进行粉碎,粉碎的目的是________________________;
(2)由反应1可知,![]() 可与________类物质反应(填物质的类别);
可与________类物质反应(填物质的类别);
(3)在加热的条件下向![]() 中加入焦炭,并通入氯气
中加入焦炭,并通入氯气![]() ,能反应生成
,能反应生成![]() 和CO,化学方程式______。
和CO,化学方程式______。
【答案】增大接触面积,有利于充分反应 碱 ![]()
。
【解析】
(1)将铝土矿的矿石进行粉碎,粉碎的目的是增大接触面积,有利于充分反应;
(2)由反应1可知,![]() 可与氢氧化钠溶液反应;
可与氢氧化钠溶液反应;
(3)在加热的条件下向![]() 中加入焦炭,并通入氯气
中加入焦炭,并通入氯气![]() ,能反应生成
,能反应生成![]() 和CO。
和CO。
(1)反应前,会将铝土矿的矿石进行粉碎,粉碎的目的是增大接触面积,有利于充分反应;
(2)由反应1可知,![]() 可与氢氧化钠溶液反应,即碱类物质反应;
可与氢氧化钠溶液反应,即碱类物质反应;
(3)在加热的条件下向![]() 中加入焦炭,并通入氯气
中加入焦炭,并通入氯气![]() ,能反应生成
,能反应生成![]() 和CO,化学方程式为
和CO,化学方程式为![]() 。
。

【题目】有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
(实验一)甲组同学进行如下探究。请完成表中空白。
实验操作 | 实验现象 | 实验结论及分析 |
Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有_____ |
Ⅱ.向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中可能含有_____物质(填“酸性”“碱性”或“中性”) |
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | _____ | 原固体粉末中一定含有Na2CO3 |
(实验二)乙组同学进行如下探究。
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素。
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)固体粉末的组成中除Na2CO3外,一定还含有的物质是_____,可能含有的物质是_____(均填写化学式)